Intoxicación por rodenticidas (raticidas) con
superwarfarinas efecto anticoagulante altamente prolongado
Marisa Riveros-Anglas 1,2, Julio Ramirez Erazo1,2,3,
Nancy Loayza-Urcia 1,4, Roxana Alarcón-Vilchez 1,5, Axel Santos-Quezada 1,5
Resumen
Joven de 19 años que realiza
intento de suicido en febrero de 2019, ingiriendo 04 bolsas de raticida “Klerat”.
Llevado a Emergencia en la ciudad de Tarapoto (Región San Martín); le realizan
lavado gástrico; recibe Fitomenadiona 2 dosis y lo envían a su casa. A los 11
días post- intoxicación presenta dolores osteomusculares, orina de color
rojizo, se añade sangrado por las encías, epistaxis, hematomas, aumenta la gingivorragia
y sensación de desvanecimiento; es llevado al Hospital de Yurimaguas. En los
exámenes de laboratorio se encuentra: INR:9.7 y alteraciones en el Tiempo de
Protrombina (TP):45 y Tiempo de Tromboplastina Parcial activada (TTPA): 60.
Recibe tratamiento con Fitomenadiona y Ácido tranexámico. Por persistir gingivorragia
escasa y alteraciones en la coagulación se hace la referencia al hospital Nacional
Dos de Mayo de la ciudad de Lima. Donde se encuentra: INR: 11.5, TP:120 seg.
TTPA: 86.5, Hb:12.2 Leucocitos:10.090 Plaquetas: 320.000, Orina: hematíes 5xc.
Leucocitos:0-1 x c. Perfil hepático: Normal, Perfil lipídico: Normal, Rx. de
Tórax. Normal, Dímero D: 0.14. Se realizan Pruebas de autoinmunidad, encontrando
el Anticoagulante Lúpico: Positivo, siendo el resto de pruebas negativas. Se dio
Tto. con Plasma Fresco congelado, crioprecipitados y Fitomenadiona. El examen de
orina en CICOTOX encontró metabolitos de hidroxicumarinas POSITIVO. Estuvo hospitalizado
por 2 meses, se logra la estabilización en el perfil de coagulación y el INR; dependientes
del Tto. con Fitomenadiona. El control de orina en CICOTOX dio negativo a los 2
meses. El control del anticoagulante Lúpico a los 3 meses dio Positivo; a los 6
meses dio Negativo. Tuvo que continuar con Tto. de Fitomenadiona por 10 meses más
(dic. 2019), hasta lograr la estabilización total del perfil de coagulación y el
INR. Para darle el Alta.
Palabras clave: Hidroxicumarinas de 2da. Generación, Dímero
D, International Normalized Ratio (INR), Tiempo de Protrombina (TP), Tiempo Tromboplastina
Parcial Activada (TTPA), Centro de Información, Control Toxicológico y Apoyo a
la Gestión Ambiental - UNMSM (CICOTOX), Anticoagulante lúpico, Fitomenadiona.
Abstract
19-year-old young man
who made a suicide attempt in february 2019, ingesting 04 bags of rat poison “Klerat”.
Taken to Emergency in the city of Tarapoto (San Martín Region); they perform gastric
lavage; Receive 2 doses of Phytomenadione and send it to your home. At 11 days post-intoxication,
he presents musculoskeletal pain, reddish urine, bleeding from the gums, epistaxis,
bruising, increased gingivorrhagia and a feeling of fainting; He is taken to
the Yurimaguas Hospital. Laboratory tests find: INR: 9.7 and changes in
Prothrombin Time (PT): 45 and Activated Partial Thromboplastin Time (APTT): 60.
He receives treatment with Phytomenadione and Tranexamic Acid. For the persistence
of scarce gingivorrhagia and coagulation disorders, the reference is made to the
Dos de Mayo National Hospital in the city of Lima. Where found: INR: 11.5, TP: 120
sec. APTT: 86.5, Hb: 12.2 Leukocytes: 10,090 Platelets: 320,000, Urine: red blood
cells 5xc. Leukocytes: 0-1 x c. Liver profile: Normal, Lipid profile: Normal,
Rx. Chest. Normal, D-Dimer: 0.14. Autoimmunity tests are performed, finding the
Lupus Anticoagulant: Positive, with the rest being negative. Tto was given. with
fresh frozen plasma, cryoprecipitate and phytomenadione. The urine test on CICOTOX
found POSITIVE hydroxycoumarin metabolites. He was hospitalized for 2 months, stabilization
is achieved in the coagulation profile and INR, dependent on Tto. with Phytomenadione.
CICOTOX urine control was negative at 2 months. Control of the Lupus anticoagulant
at 3 months was Positive; at 6 months he gave a Negative. He had to continue with
Tto. of Phytomenadione for 10 more months (Dec. 2019), until achieving total stabilization
of the coagulation profile and INR. To discharge you.
Keywords: Hydroxycoumarins
of 2nd. Generation, D-Dimer, International Normalized Ratio (INR), Prothrombin Time
(TP), Activated Partial Thromboplastin Time (TTPA), Information Center,
Toxicological Control and Environmental Management Support -UNMSM (CICOTOX), Lupus
Anticoagulant, Phytomenadione.
Introducción
Se entiende como
rodenticida a cualquier producto comercializado para matar roedores, ardillas y
otros animales pequeños. El rodenticida ideal será aquel que sea tóxico para los
roedores y no para los humanos. Se pueden clasificar en dos tipos: Hidroxicumarinas
e Indandionas; los primeros se dividen en Hidroxicumarinas de 1era.Generación donde
se encuentra la warfarina, el Cumatetralil, cumacloro y el clorofenil y las Hidroxicumarinas
de 2da.Generación o superwarfarinas donde están: la Brodifacouma, Bromadiolona,
Difenacoum, Flocumafen, Difetialona. En el grupo de las Indandionas están: Clorofacinona,
Difacinona, Pindona y Valona(1). Su presenta- ción comercial es variada,
encontrándose formulaciones tales como pellets,
pasta, minibloques, bloques o granos(2).
En la actualidad existe utilización masiva de rodenticidas.
Las etiologías de intoxicación por estos agentes son variadas pudiendo ser de tipo
intencional o accidental. En nuestro medio los reportes Estadísticos del MINSA-PERÚ(3)
informa que son los plaguicidas y
órganos fosforados que producen la mayor intoxicación en la agricultura. En cuarto
lugar, están los rodenticidas o raticidas, siendo el más común el Racumin (Cumatetralil)
que es un warfarina de 1era. Generación, que va a producir trastorno de
coagulación de presentación rápida; muy diferente a lo que ocurre con las warfarinas
de 2da.generación llamadas también Superwarfarinas. La importancia de este Caso
Clínico es alertar sobre el tratamiento adecuado, ante intoxicaciones por raticidas,
no pensar que solo es por warfarinas de primera generación, que actúan rápidamente
y con Tto. con Fitomenadiona en 4 o 5 días es suficiente. Muchos casos que han sido
por ingesta de hidroxicumarinas de segunda generación han causado inestabilidad
de los factores de coagulación recién a los 7 o 10 días causando hemorragias y muerte
por las complicaciones. El Tto. en estos casos debe ser prolongado de 2 meses
hasta 12 meses, como sucede en algunos casos.
Caso clínico
Joven de 19 años que
realiza intento de suicido en febrero de 2019, ingiriendo aproximadamente 04
bolsas de Klerat. Es trasladado a Emergencia del hospital de la ciudad de Tarapoto
(Región San Martín); le realizan lavado gástrico; permaneciendo hospitalizado unos
días, recibe Fitomenadiona 2 dosis y lo envían a su casa. A los 11 días
post-intoxicación empieza a presentar dolores osteomusculares, orina de color rojizo,
se añade sangrado por las encías, epistaxis, hematomas, aumenta la
gingivorragia y presenta sensación de desvaneci- miento, por lo que es llevado al
Hospital de Yurimaguas, donde queda hospitalizado (02-marzo-al 15-marzo-2019), los
exáme- nes de laboratorio demuestran un INR: 9.7 y alteraciones en el Tiempo de
Protrombina(TP): 45 y Tiempo de Tromboplastina Parcial activada(TTPA): 60. Recibe
tratamiento con Fitomena- diona y Ácido tranexámico. Por persistir gingivorragia
escasa y alteraciones en la coagulación se hace la referencia al hospital Nacional
Dos de Mayo de la ciudad de Lima. Ya hospitalizado se encuentra el 15-03-19,
valores de: INR: 11.5, TP:120 seg. TTPA: 86.5, Hb:12.2 Leucocitos:10.090
Plaquetas: 320.000, Orina: hematíes 5xc. Leucocitos:0-1 x c. Perfil hepático: Normal,
Perfil lipídico: Normal, Rx. de Tórax. Normal, Dímero D: 0.14. Se realizan Pruebas
de autoinmunidad, encontrando el Anticoagulante Lúpico: Positivo, siendo el resto
de pruebas negativas. Se dio Tto. con Plasma Fresco congelado, crioprecipitados
y Fitomenadiona.
Evaluación clínica: Funciones
Vitales: Presión Arterial: 130/80, Frecuencia cardíaca: 90/min. Frecuencia
respiratoria: 18/min, Pulso: 90/min, Temperatura: 37º, Glasgow: 15. LOTEP.
Sangrado escaso por encías. Piel: Palidez en piel y mucosas. Hematoma en zona
de antebrazo derecho. Otro en resolución en muslo izquierdo. Buen estado nutricional
Examen Cardiovascular: ruidos cardíacos rítmicos de buena intensidad. No
soplos. Tórax: simétrico. Murmullo vesicular pasa normal en ambos hemitórax. No
tiraje. Examen Abdominal: simétrico. Leve esplenomegalia con leve dolor a la palpación.
No hepatomegalia. No masas. RHA normales. Examen neurológico: Glasgow: 15. ROT:
disminuidos. Otros pares craneales: conservados. No déficit motor, sensitivo conservado.
Examen de cerebelo con leve alteración en la marcha estática, siendo > a 90º
a la derecha. Resto de examen normal. Cabeza: normocéfala. Pupilas
fotoreactivas. Mucosa oral húmeda. Cuello: normal. No adenopatías. No se palpa tiroides.
Miembros superiores e inferiores sin edemas. Se toman análisis de laboratorio
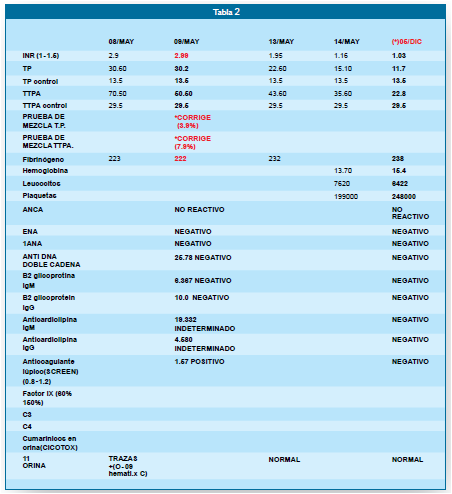
(Tabla 1), donde se evidencian alteración marcada del INR:11.5, el TP: con 120seg.
siendo el valor control de 12.5. El TTPA con 86.5 seg, siendo el control de:
29.5. Se dio Tto. con Fitomenadiona, Crioprecipitados, acido tranexámico. Se
ampliaron los exámenes de laboratorio con pruebas basales y de autoinmunidad,
Prueba de Mezclas, ecografía que confirmó la esplenomegalia. La evolución clínica
en los 3 meses de hospitalizado, fue favorable. Cedió el sangrado. Los valores
de INR, del TP y TTPA continuaron inestables a pesar del Tto. con Fitomenadiona.
Llamó la atención que al inicio se encontraran: prueba de Anticoagulante lúpico
y 2 beta glicoproteína: positivos. La prueba de metabolitos en orina en CICOTOX,
fue CUMARINAS POSITIVO. A los 3 meses la misma prueba dio resultado NEGATIVO. Al
disminuir la dosis de Fitomenadiona oral, los valores de INR, TP, TTPA se elevaron
nuevamente (Tablas 1 y 2). El examen clínico no evidenciaba alteraciones.
Continuó con Fitomenadiona vía oral. Nuevamente se constató la POSITIVIDAD del anticoagulante
lúpico. Resto de pruebas de autoinmunidad resultaron negativas. Las PRUEBAS DE MEZCLAS
para TP y TTPA (ÍNDICE DE ROSSNER)=<12%, CORREGÍAN
PARA AMBOS. A los 10 meses de la intoxicación se realizan nuevos controles, con
hallazgos del INR, TP y TTPA en valores normales. Se suspende la Fitomenadiona
por 15 días y se dosan nuevamente, siendo los valores normales; procediendo al Alta
(Figuras 1 y 2),
Exámenes auxiliares:
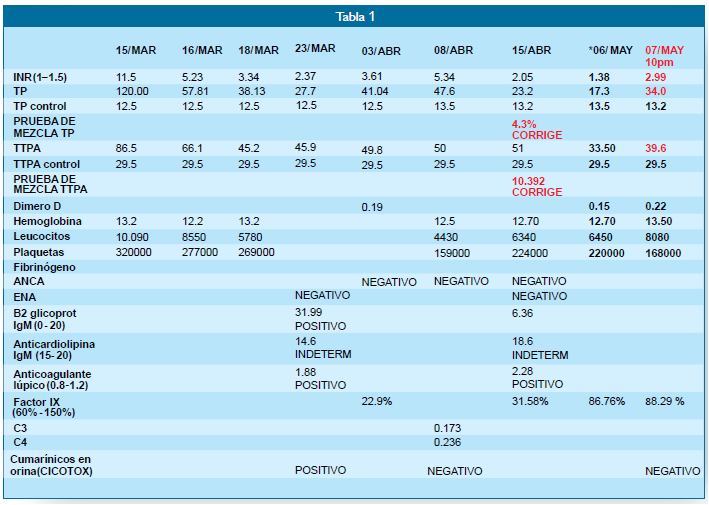
*SE HOSPITALIZA para control. Se suspende el Tto. de Fitomenadiona
el día 06/05. El día 07/05 a las 12 horas se toman controles de Perfil de coagulación.
Se evidencia elevación del INR y alteración del TP y TTPA nuevamente
Discusión
En los años setenta, se
sintetizaron las Superwarfarinas (hidroxicumarinas de 2da. generación) como un nuevo
tipo de rodenticidas debido a que los animales desarrollaron resisten- cia a la
warfarina (1era generación). Actualmente la warfarina es muy poco utilizada
como rodenticida y en cambio, hay una mayor oferta de superwarfarinas que
producen un profundo y prolongado efecto
anticoagulante de los raticidas(4). Las principales formas de intento suicida referidos
por los adolescentes en el Perú (2017): son el “cortarse las venas” el “tomar raticida”
o “tomar pastillas”, no existiendo una diferencia al respecto entre hombres y mujeres(5).
Existe una revisión(6) de la literatura de PubMed,
Science Direct, US National Library of Medicine Toxicology
Data Network y Google Scholar realizada por el Departamento de Patología de la
Universidad de california en USA en el 2015; que produjo 174 casos notificados
de intoxicación LAAR (Rodenticidas Anticoagulantes de Acción Prolongada) de los
cuales se extrajeron
y revisaron datos clínicos. Además, se revisaron 25 años de datos epidemiológicos
de la Asociación Americana de Centros de Control de Venenos. En los Estados Unidos,
en promedio, se notificaron 10,413 exposiciones con 2,750 pacientes tratados anualmente.
Durante 25 años, se notificaron 315,951 exposiciones con casi el 90% entre los
niños y más de 100,000 pacientes tratados en un centro de atención médica. Afortunadamente,
solo el 2% de todas las exposiciones resultaron en morbilidad o mortalidad. Se
han documentado vías de exposición inhaladas, transcutáneas y orales. La mayoría
de las exposiciones son involuntarias. Los sitios hemorrágicos notificados con mayor
frecuencia son mucocutá- neos, siendo la hematuria la característica más común.
Las muertes se asociaron más comúnmente con hemorragia intracraneal. También se
han observado trombosis paradójicas inducidas por rodenticida anticoagulante de
acción prolongada y complicaciones trombóticas que acompañan a la terapia hemostática.
*CORRIGE
= INDICE DE ROSSNER < 12% (VALOR= <10% : CORRIGE, > 15%: NO CORRIGE)
La biodisponibilidad oral
de las warfarinas es cercana al 100% y se distribuye en el hígado, pulmones,
bazo y riñones. Usualmente la warfarina se detecta en sangre a la hora después de
su ingestión y el pico de concentración plasmática ocurre entre 2 a 8 horas. La
presencia de alimento en el tracto gastrointestinal puede disminuir la
absorción. Posee una alta unión a proteínas plasmáticas (aproximadamente
97-99%), principalmente a la albúmina. No parece llegar a la leche materna en
cantidades significativas, pero sí cruza la barrera placentaria. Su rango
efectivo de vida media de las hidroxi- cumarinas de 1era. generación está entre
20 a 60 horas. Con duración de acción entre 2 a 5 días. Las superwarfarinas se absorben
con facilidad, por vía oral, por la piel y la vía inhalatoria. Tienen circulación
enterohepática y son eliminados en las heces y en la orina. Estas sustancias
saturan las enzimas hepáticas en concentraciones muy bajas. Son 100 veces más
potentes que la warfarina y muestran una duración de acción más prolongada, la cual
puede ir de semanas a meses, aún después de una sola dosis. Se han informado vidas
medias entre 6 días, 160 hasta 300 días(2,4). Esa es la explicación del
trastorno de coagulación de nuestro paciente, de casi 10 meses(6,7).
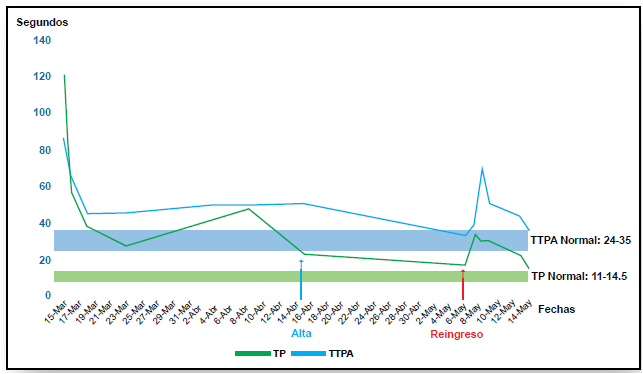
Figura 1. Curva de TP y TTPA.
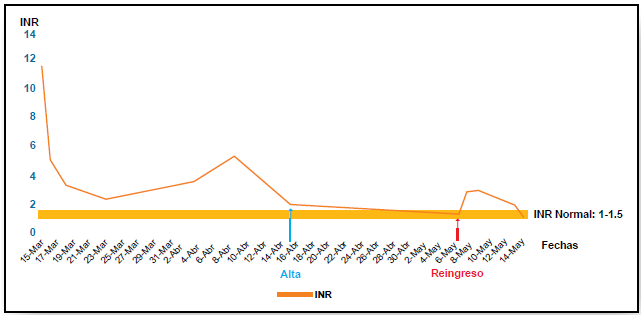
Figura 2. Curva del INR. Relación Normalizada Internacional.
Las hidroxicumarinas de
1era. y 2da.Generación (raticidas) son antagonistas específicos de la Vitamina
K. Los superwarfarínicos actúan de manera similar a la warfarina, inhibiendo la
enzima vitamina K1 2,3 epóxido reductasa y con ello la síntesis de vitamina K1
(Fitomenadiona) y la posterior falta de activación de los factores de coagulación
II, VII, IX y X. Estos factores se alteran casi inmediatamente después de la ingestión
de este tipo de sustancias, sin embargo, los síntomas no se observan recién 2 a
7 días después.
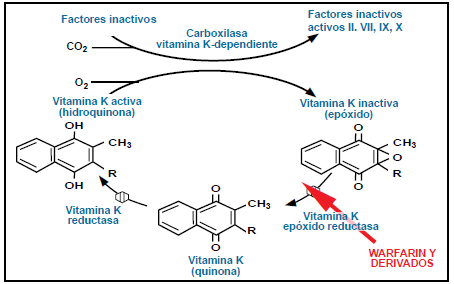

 Figura 3. Las hidroxicumarinas de
1era. y 2da.Generación (raticidas) son antagonistas específicos de la Vitamina K.
Los superwarfarínicos actúan de manera similar a la warfarina, inhibiendo la enzima
vitamina K1 2,3 epóxido reductasa y con ello la síntesis de vitamina K.
Figura 3. Las hidroxicumarinas de
1era. y 2da.Generación (raticidas) son antagonistas específicos de la Vitamina K.
Los superwarfarínicos actúan de manera similar a la warfarina, inhibiendo la enzima
vitamina K1 2,3 epóxido reductasa y con ello la síntesis de vitamina K.



 Estas sustancias no
afectan al inicio la actividad de los factores de coagulación circulantes; el inicio
de acción se retra- sa hasta agotar los depósitos de estos factores, lo cual depende
de la vida media de degradación de cada factor. El factor II requiere 60 horas;
el factor VII requiere de 4-6 horas (es el que se depleta con mayor rapidez); el
factor IX requiere 24 horas y el factor X requiere 48-72 horas(4,8) (Figura 4).
Estas sustancias no
afectan al inicio la actividad de los factores de coagulación circulantes; el inicio
de acción se retra- sa hasta agotar los depósitos de estos factores, lo cual depende
de la vida media de degradación de cada factor. El factor II requiere 60 horas;
el factor VII requiere de 4-6 horas (es el que se depleta con mayor rapidez); el
factor IX requiere 24 horas y el factor X requiere 48-72 horas(4,8) (Figura 4).
Los hallazgos más comunes
de anticoagulación excesi- va son: equimosis, petequias y hematomas alrededor
de las articulaciones y los glúteos, palidez, hematemesis, sangrado de las
encías o gingivorragia, sangre en la orina (hematuria) o en las heces (melena),
hemorragia subconjuntival, epistaxis, hemorragia vaginal, aborto espontáneo,
hemorragia del siste- ma nervioso central, etc.
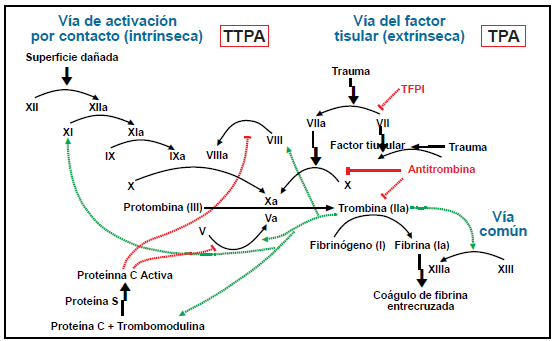


 Figura 4. VIA INTRÍNSECA Y EXTRÍNSECA
DE LA COAGULACIÓN. El factor II requiere 60 horas para su degradación ; el factor
VII requiere de 4-6 horas (es el que se depleta con mayor rapidez); el factor IX
requiere 24 horas y el factor X requiere 48-72 horas
Figura 4. VIA INTRÍNSECA Y EXTRÍNSECA
DE LA COAGULACIÓN. El factor II requiere 60 horas para su degradación ; el factor
VII requiere de 4-6 horas (es el que se depleta con mayor rapidez); el factor IX
requiere 24 horas y el factor X requiere 48-72 horas
La alta
liposolubilidad, la circulación enterohepática (Watt y col. 2005) y fijación marcada
a enzimas hepáticas, son características que explican por qué el efecto
anticoagulante puede persistir desde varios días hasta meses, incluso cuando ya
no son detectables en plasma sanguíneo (Lipton y col. 1984) o en orina. Es por
ello que a pesar de que a los 3 meses el examen de orina de nuestro paciente dio
en CICOTOX: Negativo, los efectos de las superwarfarinas persistieron(2,9).
Existen diversos estudios
que han tratado de establecer la dosis tóxica y severidad del cuadro clínico
según la dosis ingerida, un ejemplo es el de Wu, quien mostró que ingestas de brodifacouma
en dosis entre 4,5 a 24 mg, causaron sangrados, que fueron evidenciados por
presencia de hematuria, gingivo- rragia y equimosis múltiple, asociado a tiempos
de protrombina (TP) extremadamente prolongados (Wu y col. 2009)(9).
La cantidad de
principio activo contenido en cada uno de los 45 rodenticidas superwarfarínicos
registrados en Chile es variable; en Perú no se tiene registro exacto; sin
embargo, la mayoría de los productos formulados en pellets vienen en bolsa de 10
gramos con 50 pellets, que equivale a: 0.5 mg de activo. Para tener el principio
activo, se debe tener 1mg que corresponde al consumo de 2 bolsas, es decir, alrededor
de 100 pellets. Respecto a los bloques la mayoría contiene 20 gramos lo que corresponde
a 1 mg de activo(2). Con dosis de 2mg se producen efectos moderados y con dosis
de 4mg a más constituye dosis letal. En el caso de nuestro paciente consumió poco
más de 4 bolsas de 10 gr de un producto Klerat que contiene BRODIFACOUMA, ello
significaba 40gr = 2mg de veneno aproximadamente. Se considera intoxicación
leve a la presencia de efectos locales, con irritación del tracto gastrointestinal,
caracterizados por: dolor abdominal, diarrea y vómitos (Flomenbaum 2011). La
intoxicación moderada hace referencia a la aparición de sangrados que no ponen en
riesgo la vida del paciente, tales como: equimosis, hematomas, hemartrosis,
epistaxis, gingivorragia, hematoquecia, melena, hematuria, menometrorragia, hematemesis,
hemoptisis (Lipton y col. 1984; Barnett y col. 1992; Flomenbaum 2011). Finalmente,
se define como intoxicación severa, cuando exis- ten hemorragias graves que
pueden comprometer la vida del enfermo, como: hemorragias gastrointestinales
masivas, pul- monar o intracraneal (Watt y col. 2005; Caravati y col. 2007)(10).
El manejo clínico de estos
pacientes está indicado solo para aquellos que posean factores de riesgo
asociados o que hayan consumido al menos 1 mg de brodifacouma. Debiendo tenerse
en cuenta, que la ausencia de signos o síntomas no excluye una potencial ingesta
tóxica, por lo que se debe acudir a un servicio médico de urgencia, si alguno de
los dos criterios antes mencionados se cumple (Watt
y col. 2005)(1,2).
La realización de lavado gástrico puede ser
considerada en caso de ingestas masivas y solo dentro de la primera hora
posterior a ésta, no existiendo evidencia disponible que indique que esta medida
reduzca su absorción (Ingels y col. 2002; Benson y col. 2013). El examen de
laboratorio de referencia es la detección de alteraciones en el INR. El cual
debe ser realizado a todo paciente derivado a un servicio de urgencias. Algunos
autores concluyen que se debe medir a las 36 y 48 horas y que, en caso de
resultar normales, no se requiere mayor manejo clínico (Watt y col. 2005). Debe
realizarse seguimiento cuidadoso a estos pacientes, ya que no siempre se logra
determinar que raticida ha consumido.
El tratamiento está
relacionado con la severidad del cuadro clínico, la cantidad suministrada y con
las circunstan- cias del evento. En este orden de ideas deben ser evaluados hospitalariamente
los pacientes con exposiciones suicidas, los que ingieren grandes cantidades o
pacientes con exposiciones crónicas, tomando pruebas de coagulación antes de
iniciar vitamina K, plasma fresco congelado o factores específicos de coagulación.
Los pacientes asintomáticos o con ingestiones de menos de un miligramo de
ingrediente activo, pueden ser monitoreados ambulatoriamente, siempre que se
pueda titular pruebas de coagulación, 48 a 72 horas post exposición. Los pacientes
con exposiciones dérmicas importantes deben ser descontaminados mediante lavado
con agua y jabón(11). En el caso que existan alteraciones de la TP (50-80%), se
aconseja administrar 10 mg vía oral (VO) o IV de VK y control de la TP cada 24
h. Si es igual o inferior al 50% y el paciente presenta algún tipo de sangrado,
se recomienda administrar 0,1-3 mg/Kg/día de VK cada 6-8 h VO/IV. Hoy en día se
puede administrar vía IV. Si existiera riesgo vital, se puede añadir complejo protrombínico
y/o plasma fresco congelado(1). Una vez estabilizado el cuadro, si no se dispone
de técnicas croma- tográficas para identificar y cuantificar el producto ingerido,
se recomienda administrar 10 mg de VK cada 24 h VO2-20 durante semanas/meses, con
control semanal de la TP, INR(1,7).
El Anticoagulante lúpico
se detecta utilizando ensayos funcionales que demuestran un alargamiento del
tiempo de coagulación dependiente de fosfolípidos (FL), debido a la interferencia
in vitro de anticuerpos con función dependiente de FL, como con algunos
cofactores esenciales en la cascada de coagulación acarrean la prolongación del
tiempo parcial de tromboplastina activada(12). Se ha descrito una prevalencia del
5% en la población general adulta y hasta un 9,5% en mujeres en edad reproductiva(12).
Son llamados
anticoagulantes endógenos adquiridos, conocidos como inhibidores, y de ellos el
más frecuente es el anticoagulante lúpico. Una forma de diferenciarlos es mediante
la corrección con plasma normal: PRUEBA DE MEZCLAS O DE ROSSNER (VN:<12%) que
se realiza con un volumen del plasma del paciente más un volumen de plasma
normal; si corrige se trata del efecto de medicamentos, si no corrige se trata de
un inhibidor adquirido(13-15).
La hemoptisis es un síntoma
preocupante para los pacientes que sufren intoxicación accidental por inhalación
de brodifacouma, que puede representar un desafío diagnóstico para los médicos(16).
El uso de Brodifacouma, se ha notificado como causa de coagulopatías graves en
seres humanos, tanto intencionales como involuntarias, incluso consumidas como un
contaminante de las hierbas, como el cannabis. Resulta de gran importancia el
enfoque multidisciplinario y en la interacción colaborativa de aspectos clínicos
y toxicológicos(17).
La exposición al difenacoum
al menos 4-5 días, antes de la hospitalización, también puede ser confirmada por
la presencia del rodenticida en el bulbo capilar del cabello(18).
Por todo lo anterior,
resulta de importancia presentar este caso, donde se evidencia el efecto
prolongado de los raticidas como las hidroxicumarinas de 2da. generación. Importancia
del tratamiento oportuno, diagnóstico, detección y seguimiento. La gran
repercusión de estas sustancias en los factores de coagulación, el riesgo de sangrado
posterior; situación que para muchos clínicos en Emergencia pasa desapercibida y
no se toma en consideración. Las intoxicacio- nes por rodenticidas traen
consigo una alta morbilidad y sin intervenciones médicas precisas y oportunas
pueden llegar a ser letales. Es importante fortalecer el diagnóstico y la monitorización
post-tratamiento(19,20).
La alta
liposolubilidad, la circulación enterohepática (Watt y col. 2005) y fijación marcada
a enzimas hepáticas, son características que explican por qué el efecto
anticoagulante puede persistir desde varios días hasta meses, incluso cuando ya
no son detectables en plasma sanguíneo (Lipton y col.1984).
Referencias bibliográficas
1. Iglesias Lepine
ML, Epelde Gonzalo F, Casañas Ferrer
F, Gené Tous E. Intoxicación por rodenticidas superwarfarínicos en adultos: bromadiolona, brodifacoum y Difetialona. Emergencias 2013;25:201-203.
2. Gallardo Ferrada AI, Lizana Gajardo F, Gutiérrez Torres
W. Intoxicaciones con
rodenticidas superwarfarínicos. Acta Toxicológica de Argentina. 2015;23(1):44-52.
3. UNMSM-DIGESA-ENSAP. Diagnóstico, Tratamiento y Prevención de
Intoxicaciones aguda causadas por Plaguicidas,
Rodenticidas y Fumigantes. Curso a distancia para
médicos y Enfermeras. 1992.
4. Saracco S. Departamento de Toxicología. Universidad de Sevilla. Boletín del Servicio de
Toxicología-Mendoza Salud. Argentina. 2014
5. Documento Técnico: Situación de Salud de los Adolescentes y
Jóvenes en el Perú. Ministerio de Salud
del Perú. Dirección General de Intervenciones Estratégicas en Salud Pública.
Dirección de Intervenciones
por Curso de Vida y Cuidado Integral. 2017:66-69.
6. Long J, Peng X, Luo Y, Sun Y,
Lin G, Wang Y, Qiu Z. Treatment of a long-acting anticoagulant rodenticide poisoning
cohort with vitamin
K1 during the maintenance period. Medicine (Baltimore). 2016;95(51):e546.
7. Rey N, Minh-HaTran. Intoxicación por rodenticida anticoagulante de acción prolongada (Superwarfarin): Una revisión de su
desarrollo histórico, epidemiología y gestión
clínica. Departamento de Medicina de Laboratorio de Patología, Universidad de California, Irvine Medical Center,
Orange, CA, Estados
Unidos. Transfusion Medicine
Reseñas. 2015;29(4)250-258.
8. Robles Pera L, Benavent
Boladeras R. Trastornos de la
Coagulación. Cap.66. Tratado de Geriatría
para residentes. 2005.
9. Wu YF, Chang CS, Chung CY, Lin HY, Wang CC, Shen MC. Superwarfarin intoxication: hematuria is a major clinical manifestation. Int J Hematol. [en línea] 2009;90(2):170-173. [Consulta
23 de marzo 2014]. Disponible en: http://link.springer.com/article/10.1007/ s12185-009-0374-6.
10. Ng WY, Ching CK, Chong YK, Ng SW, Cheung WL, Mak TWL. Estudio retrospectivo de las características de la intoxicación por rodenticida de tipo
anticoagulante en Hong Kong. Laboratorio de Referencia en Toxicología de la Autoridad
Hospitalaria, Hospital Princess
Margaret, Kowloon, Hong Kong. Revista de Toxicología Médica.
2018;14(3):218-228.
11. Galofre-Ruiz MD,
MSc1, Padilla-Castañeda EI, MSc. Intoxicación con rodenticidas: casos reportados al Centro de Información,
Gestión e Investigación en Toxicología de la
Universidad Nacional de Colombia. Rev. Fac. Med. 2014;62
(1):27-32.
12. Valor L,
Hernández-Flórez D, Martínez-Barrio J, López
Longo FJ. Una reflexión sobre
el anticoagulante lúpico: cómo lo
definimos, determinamos e interpretamos. Servicio de Reumatología, Hospital General Universitario Gregorio Marañón, Madrid, España. Reumatología Clínica 2018;14(2):120-122.
13. López-Santago N. Pruebas de coagulación. Acta
Pediátrica Mex. 2016;37(4):241-245.
14. Forastiero R. Desafíos en la interpretación del Perfil de los anticuerpos
antifosfolípidos. HEMATOLOGÍA
Volumen 22 o Número Extraordinario XIII Congreso del Grupo CAHT:
68-72. Septiembre 2018.
15. Recomendaciones sobre síndrome
Antifosfolípido primario.
Sociedad española de Reumatología (SER). 2019:4- 6, 10-15.
16. Sharma RL, Chong K. Presentación inusual de la hemoptisis tras la inhalación accidental del brodifacouma de rodenticida “superwarfarina”. Departamento de Medicina Respiratoria, East y North Hertfordshire NHS Trust, Stevenage, Reino Unido. BMJ. 2019;12(11).
17. Foti F, Sica SB,
Alma EC, De Cristofaro RD, Mores NE, Vetrugno
G. Sangrado nasal repentino y bromacoum: ¿Un caso de exposición accidental o intento
de homicidio?. Unidad
de Cirugía Vascular, Fondazione Policlinico Universitario A. Gemelli
IRCCS, Roma-Universidad Católica
del Sacro Cuore,
Roma, Italia. Medicina Legal. Volumen 47, noviembre de 2020,
Artículo número 101772
18. Carelli C, Fais PB, Freni F, Moretti M, Morini. Importancia del análisis del vello segmentario en un
caso sospechoso de intento de homicidio por flocoumafeno y difenacoum. Internacional de
Ciencias Forenses.Volumen 316, noviembre de 2020, Artículo
número 110466.
19. Zuo W. Un, Zhang, XB, Chang J.-B.B, Ma,W.-B.B, Wei, J.- JB. Intoxicación
por bromadiolona que conduce a hemorragia subaracnoidea:
Un informe de caso y revisión de la literatura. Revista de Farmacia Clínica y
Terapéutica.Volumen 2019;44, (6):958-962
20. Li Q.Un, Yu W.Un, Qu Y.Un, Wang J.-Q.B, Mao NC, Kang. Encefalopatía tóxica aguda después de la intoxicación por bromadiolona: un informe del caso. BMC
Neurología. 2021; 21(1).
1Médico Cirujano, 2,3Servicio
Santo Toribio, Hospital Nacional Dos de Mayo (HNDM), 4Servicio de Hematología,
Hospital Nacional Dos
de Mayo, 5Hospital Villa
Panamericana de Villa El Salvador. Códigos ORCID: MRA: 0000-0001-5792-4552.
RAAV: 0000-0002-3939-
6167. AMSQ: 0000-0002-4941-308X
Contribución de
autoría: Marisa Riveros-Anglas ha participado en la concepción del artículo,
recolección de datos, redacción, revisión crítica del manuscrito, discusión y
aprobación de su versión final. Julio Ramírez- Erazo y Nancy Loayza-Urcia
participaron en la discusión. Roxana Alarcón-Vichez y Axel Santos-Quezada
participaron en el resumen y preparación de las tablas 1 y 2.
Conflicto de interés: El autor y coautores no tienen
conflicto de interés con la publicación de este trabajo.
Financiamiento: Autofinanciado
Citar como: Marisa Riveros-Anglas y cols. Intoxicación
por redenticidas (raticidas) con superwarfarinas efecto anticoagulante
altamente prolongado. Diagnóstico(Lima). 2021;60(2):104-112.
DOI: 10.33734/diagnostico.v60i2.288
Correspondencia: Marisa Riveros Anglas. Correo
electrónico: marisaoskr@gmail.com