CARCINOMA GÁSTRICO
Carcinoma Gástrico
Factores de riesgo.
Rol del Helicobacter pylori
Manuel Valdivieso
Rodríguez, M.D.
Director de Educación, Peruvian American Medical
Society (PAMS)
https://orcid.org/0000-0002-3292-1475
Resumen
El carcinoma gástrico
es uno de los cánceres más frecuentes y más letales en el Perú. Los factores de
riesgo son múltiples; destacando al sexo masculino y edad avanzada, ingesta
alta de sal, alimentos conservados en sal, carnes y pescados ahumados o secos,
alimentos encurtidos, baja refrigeración, baja ingesta de frutas y verduras con
baja ingesta de vitaminas A y C, infecciones al virus Epstein Barr y al
Helicobacter pylori, exposición a radiación, factores genéticos múltiples,
bajos niveles de actividad física, obesidad y pobreza o bajo nivel
socioeconómico. La infección de la mucosa gástrica por Helicobacter pylori,
Carcinógeno tipo 1, produce lesiones progresivas y sucesivas que pueden
evolucionar a través de una serie de pasos intermedios, de gastritis a cáncer.
El daño de la infección en la mucosa gástrica puede ser reversible con el
tratamiento de la infección excepto cuando se llega a metaplasia intestinal que
con frecuencia representa el denominado “punto de no retorno”. La emergencia de
resistencia antibiótica del Helicobacter pylori impide la recuperación de las
lesiones histológicas y facilita el desarrollo del cáncer gástrico.
Palabras clave:
Cáncer gástrico, factores de riesgo, Helicobacter pylori.
Abtract
Gastric carcinoma is
one of the most frequent and most lethal cancers in Peru. The risk factors are
multiple; highlighting the male sex and advanced age, high salt intake, foods
preserved in salt, smoked or dried meats and fish, pickled foods, low
refrigeration, low intake of fruits and vegetables with low intake of vitamins
A and C, Epstein Barr virus and Helicobacter pylori infections, radiation
exposure, multiple genetic factors, low levels of physical activity, obesity,
and poverty or low socioeconomic status. The infection of the gastric mucosa by
Helicobacter pylori, a type 1 carcinogen, produces progressive and successive
lesions that could evolve through a series of intermediate steps, from
gastritis to cancer. The damage of the infection in the gastric mucosa can be
reversible with the treatment of the infection except when intestinal
metaplasia is reached, which often represents the so-called “point of no
return”. The emergence of antibiotic resistance of Helicobacter pylori prevents
the recovery of histological lesions and facilitates the development of gastric
cancer.
Keywords: Gastric
cancer, risk factors, Helicobacter pylori.


 Antecedentes
Antecedentes
El cáncer es un mal
frecuente y se estima que en el año 2020, hubieron más de 19 millones de
diagnósticos nuevos y más de 9 millones de muertes debidas al cáncer en el
mundo (Tabla 1). En orden descendiente, los cánceres más frecuentes son los de
mama, pulmón, colorectal, próstata, estómago, hígado y cuello uterino. La
mortalidad varía de cáncer a cáncer y en forma descendiente las causas de
muerte más frecuentes por cáncer en el mundo son los de pulmón, colorectal,
hígado, estómago, mama, esófago y cuello uterino(1).
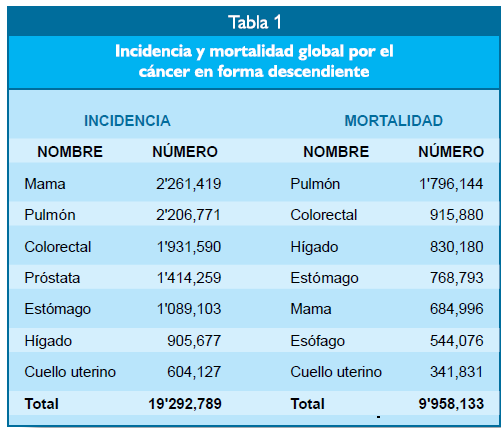

 El carcinoma del
estómago es uno de los más frecuen- tes, ocupando el quinto lugar en
frecuencia, y el número cuatro en mortalidad global en el año 2020. Esto
representa 1'089,103 de diagnósticos nuevos y 768,793 de muertes al año. Es más
común en el Asia Oriental, particularmente en China, Japón, Corea del Sur;
Europa del Este, Centroamérica y Sudamérica. Áreas de baja incidencia incluyen
a Australia, Nueva Zelanda, América del Norte, Europa Occidental, Asia -sub
Central y la mayor parte del África.
El carcinoma del
estómago es uno de los más frecuen- tes, ocupando el quinto lugar en
frecuencia, y el número cuatro en mortalidad global en el año 2020. Esto
representa 1'089,103 de diagnósticos nuevos y 768,793 de muertes al año. Es más
común en el Asia Oriental, particularmente en China, Japón, Corea del Sur;
Europa del Este, Centroamérica y Sudamérica. Áreas de baja incidencia incluyen
a Australia, Nueva Zelanda, América del Norte, Europa Occidental, Asia -sub
Central y la mayor parte del África.
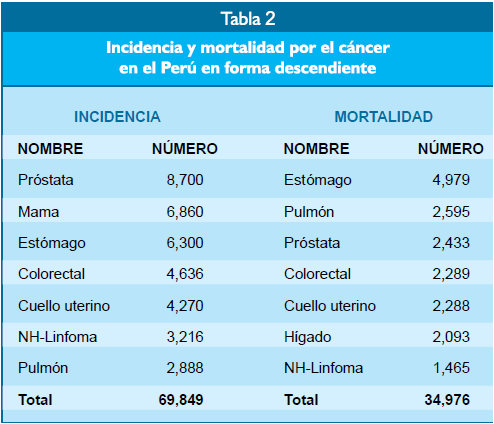
La frecuencia de casos nuevos y de mortalidad debida
al cáncer en forma descendiente en el Perú se muestra en la tabla 


 2. De acuerdo a
Globocan en el año 2020, el cáncer gástrico fue tercero en frecuencia detrás
solamente a cánceres de próstata y mama; mientras que fue el primero en
mortalidad seguido de cánceres del pulmón, próstata y colorectal(1). La
mortalidad por el cáncer de estómago en nuestro medio y en muchos países de
Centroamérica y América del Sur se debe a lo avanzado de este cáncer cuando se
le diagnostica. Se estima que hasta el 75% de pacientes con cáncer,
incluyendo los del estómago, se presentan al Instituto Nacional de Enfermedades
Neoplásicas e Lima en estado avanzado(2).
2. De acuerdo a
Globocan en el año 2020, el cáncer gástrico fue tercero en frecuencia detrás
solamente a cánceres de próstata y mama; mientras que fue el primero en
mortalidad seguido de cánceres del pulmón, próstata y colorectal(1). La
mortalidad por el cáncer de estómago en nuestro medio y en muchos países de
Centroamérica y América del Sur se debe a lo avanzado de este cáncer cuando se
le diagnostica. Se estima que hasta el 75% de pacientes con cáncer,
incluyendo los del estómago, se presentan al Instituto Nacional de Enfermedades
Neoplásicas e Lima en estado avanzado(2).
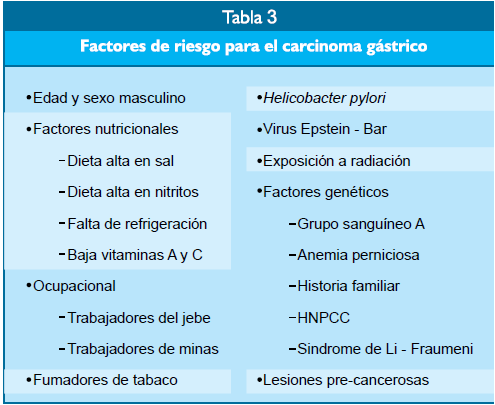
Factores de riesgo


 Los factores de
riesgo para el cáncer gástrico son últiples (Tabla 3). Incluyen al sexo
masculino, edad avanza- a, ingesta alta de sal, alimentos conservados en sal,
carnes y escados ahumados o secos, alimentos encurtidos, baja efrigeración,
baja ingesta de frutas y verduras con baja ingesta e vitaminas A y C; infección
debida al Helicobacter pylori y al virus Epstein Barr, exposición a radiación,
factores genéticos múltiples, bajos niveles de actividad física, obesidad y
nivel socioeconómico bajo(3-5).
Los factores de
riesgo para el cáncer gástrico son últiples (Tabla 3). Incluyen al sexo
masculino, edad avanza- a, ingesta alta de sal, alimentos conservados en sal,
carnes y escados ahumados o secos, alimentos encurtidos, baja efrigeración,
baja ingesta de frutas y verduras con baja ingesta e vitaminas A y C; infección
debida al Helicobacter pylori y al virus Epstein Barr, exposición a radiación,
factores genéticos múltiples, bajos niveles de actividad física, obesidad y
nivel socioeconómico bajo(3-5).
La relativa
importancia de diferentes factores de riesgo en relación al desarrollo del
carcinoma gástrico es variable y difícil de especificar. La falta de
refrigeradora en, por lo menos, el 51% de hogares del Perú es preocupante ya
que ello conlleva un mal estado de conservación de alimentos en casa(6). Se
dice que la falta de ingesta de frutas y de vegetales en la dieta son
responsables por el 40% al 30% de cánceres gástricos. El tabaquismo e
infecciones por el virus Epstein Barr son importantes en el 18% y 13%
respectivamente. Algunos proveen la información sobre el riesgo de desarrollar
cáncer gástrico como número de veces que este ocurriría si la infección por el
Helicobacter pylori está presente (2 a 20 veces), la presencia de gastritis
atrófica (3 a 18 veces), de anemia perniciosa (2 a 6 veces) o la presencia de
bajo estado socioeconómico (2 veces)(7-9).
La distribución de la
pobreza y de la mortalidad por carcinoma gástrico en los diferentes
Departamentos del Perú fue mostrada por Piñeros et al.(10) (Figuras 1 y 2). En el panel izquierdo
de la figura 1 se ven los diferentes departamentos de la costa, la sierra y de
la selva. En el panel de la derecha de esta figura se observa la severidad
porcentual de la pobreza reflejada por la intensidad de la coloración
roja/morada que es mayor en ciertas partes de la sierra y de la selva. La pobreza es más alta en los departamentos de Huancavelica, Ayacucho y Apurimac;
pero también en Cajamarca, Huánuco, Pasco, Piura y Puno. La figura
2 muestra que el porcentaje de mortalidad por cáncer gástrico es más alto
también en regiones pobres de la sierra del Perú como son Huánuco,
Huancavelica, Pasco y Cajamarca siendo la mortalidad en estas regiones de dos a
tres veces más alta que la cantidad promedio de mortalidad del cáncer gástrico
de 16.3/100,000 habitantes. Por consiguiente, la incidencia y la mortalidad por
cáncer del estómago en el Perú son más altas en regiones pobres de la sierra.
Esta observación de mayor incidencia y de mortalidad por cáncer gástrico en las
regiones montañosas de América Latina ha sido reportada por otros autores
anteriormente(11).
Rol del Helicobacter
pylori
Uno de los factores
de riesgo más importantes en cáncer gástrico
es la infección
por el Helicobacter
pylori (12). Este organismo
flagelar gran negativo fue identificado como causa de úlceras del estómago por
Marshall y Warren en 1983 y ello los llevó a recibir el premio Nobel de
Fisiología en 2005. El Helicobacter pylori está presente en un 50% de la
población del mundo siendo mucho más común en áreas donde existe más casos de
cáncer del estómago. El Helicobacter pylori tiene potencial carcinogénico de
fuerza y se le conoce como Carcinógeno de Tipo I, como lo es el cigarrillo en relación al cáncer del pulmón. El Helicobacter pylori produce una serie de lesiones consecutivas en la mucosa gástrica, conocida como la “Cascada de Correa” en homenaje al Dr. Pelayo Correa, quien describió esta secuencia(12,13). El Helicobacter pylori no es compatible con el medio ácido del estómago pero sobrevive en él debido a la presencia de catalasa y ureasa que neutralizan al acido gástrico.
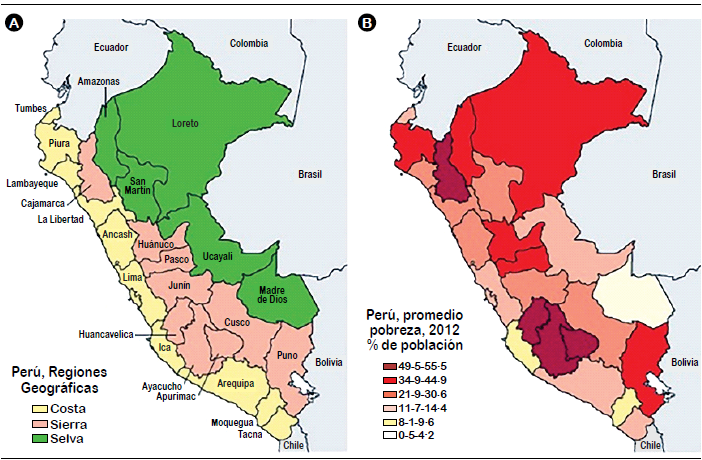
Figura 1. El Estado
de Pobreza en el Perú de acuerdo a Departamento. La Figura muestra los
Departamentos de la
costa, sierra y selva del Perú en el lado izquierdo y, el grado de pobreza en
estos Departamentos de acuerdo a la intensidad del color rojo/morado en el lado
derecho.
De: Marion Piñeros et
al. Lancet Oncol 2017;18 e573-586.
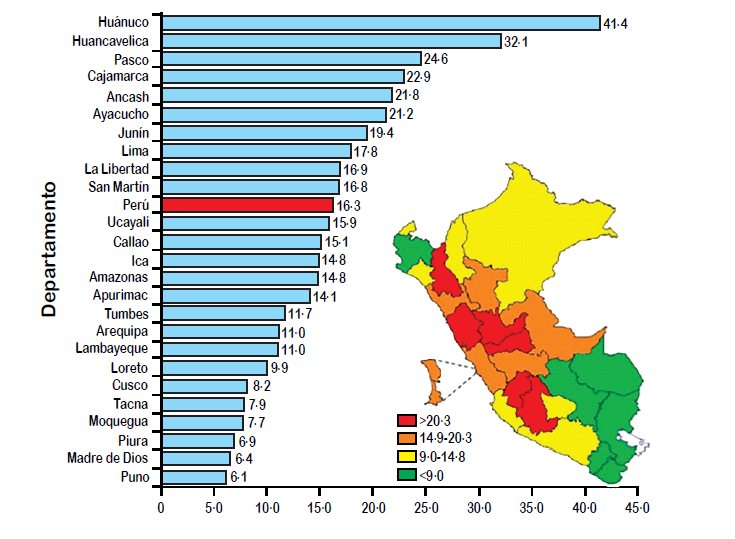
Figura 2: Mortalidad
por Cáncer Gástrico en el Perú de acuerdo a Departamento. La figura
muestra que la mortalidad por Carcinoma Gástrico es más alta en los
Departamentos más pobres de la sierra como Huánuco, Huancavelica y Pasco. De:
Marion Piñeros et al. Lancet Oncol 2017;18 e573-586.
La infección por el
Helicobacter pylori es más frecuente en medios socioeconómicos bajos y es
generalmente asintomática. De acuerdo a Peek et al.(14), el Helicobacter
pylori causa de por si una serie de trastornos que incluyen la úlcera péptica
en el 10% de casos, adenocarcinoma gástrico en un 2- 3% y en menor frecuencia
el linfoma de la mucosa gástrica o Maltoma en un ˂0.1%. La irritación crónica causada por la infección al Helicobacter pylori
estimula la generación de radicales de oxígeno y de nitrógeno que son dañinos
para el ADN, causando mutaciones en las
células madres del estómago (14). El factor de patogenicidad Cag A del
Helicobacter pylori produce alteraciones en la metilación del ADN y degrada e
inactiva al gene protector p53(15). Debe notarse que la presencia del factor de
virulencia Cag A no es constante estando presente en un 100% de las sepas de
Helicobacter pylori en el Asia y en un 60% de las sepas del Occidente(14).
La secuencia de
lesiones gástricas causadas por el Helicobacter pylori incluyen la gastritis
crónica, la metaplasia intestinal, la displasia y el cáncer. La
gastritis crónica representa un estado de inflamación crónica que causa
hipoclorhidria, la cual altera el metabolismo del fierro y se asocia con
alteraciones del microbioma
intestinal(14-16). La gastritis
crónica aumenta 10 veces la posibilidad de desarrollar cáncer gástrico. Antes de llegar al siguiente paso, metaplasia intestinal, el tratamiento
de la infección causada por el Helicobacter pylori puede mejorar el daño
histológico de la mucosa del estómago. En metaplasia
intestinal es más difícil de hacerlo. Por ello, la metaplasia intestinal es
llamada el “punto de no retorno”(17). Estudios en Corea del Sur han demostrado
que este estadio se asocia con una posibilidad alta de 187 veces de desarrollar
cáncer gástrico en comparación a controles. Además, el tiempo medio del
desarrollo del cáncer es de 6.1 años(17). El siguiente estadio es el de
displasia en la que Huang et al. han descrito amplificaciones del cromosoma 8q
que consiste en la duplicación de parte del brazo largo del cromosoma 8 y de
tener telómeros cortos(18). Los telómeros son una secuencia del ADN que están
en los extremos del cromosoma protegiendo la integridad del ADN. La agresividad
de este estadio se aprecia en el desarrollo del cáncer en solo 2.6 años(17).
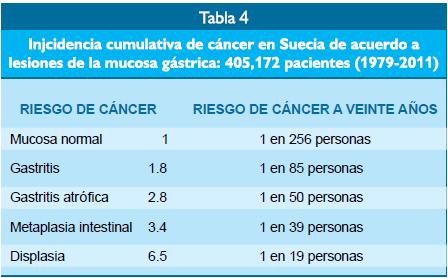
El progreso de
lesiones gástricas sospechadas debidas a infección por Helicobacter pylori se
aprecia también en países con incidencia baja de este cáncer (Tabla 4). En el
estudio de Song et al. en Suecia se evaluaron 405,172 pacientes con
lesiones gástricas entre
1979 y 2011(19).
Se demostró que la
evolución progresiva de lesiones del estómago se asoció con un incremento en la
frecuencia del carcinoma gástrico de 1 en pacientes con mucosa normal hasta 6.5
veces en pacientes con displasia. Este riesgo progresivo de desarrollar cáncer
gástrico con el avance de las lesiones de la mucosa del estómago también se
apreció viendo la evaluación porcentual del desarrollo del cáncer de 1 en 256
personas con mucosa normal a 1 en 19 personas cuando los pacientes tuvieron
displasia. Por consiguiente, existe una relación linear entre la severidad de
las lesiones gástricas causadas por el Helicobacter pylori y la posibilidad de
desarrollar cáncer gástrico aún en países con baja incidencia de cáncer
gástrico.
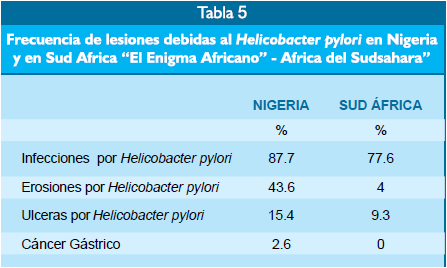
El rol del
Helicobacter pylori como agente causal del cáncer gástrico es variable a través
del mundo. El estudio de Pilamides et al.(20) examinó esta variabilidad en el
África, donde el riesgo de carcinoma gástrico es bajo a pesar de tener infecciones
causadas por el Helicobacter pylori. El estudio comparó la patogenicidad de
la infección en Nigeria y en Sud África y se apreció, que a pesar de que en
ambas regiones existe la infección por el Helicobacter pylori, que el
porcentaje de erosiones, ulceraciones y de cáncer gástrico debido al
Helicobacter pylori fueron más altos en Nigeria que en Sud África. El estudio
de Pilamides en Nigeria y Sud África incluyó endoscopias y biopsias gástricas
en ambas regiones para aislar al Helicobacter pylori y estudiar sus diferentes
marcadores moleculares en relación a los hallazgos patológicos. Encontraron que
la composición molecular del Helicobacter pylori desde el punto de vista de la
expresión de los factores patogenéticos Cag A y Vac A fue diferente y mucho más
frecuente en Nigeria que en Sud África. Igualmente, se observó que la
composición genética del Vac A fue diferente constituyendo un mosaicismo
distinto entre Nigeria y Sud África. Por consiguiente, parecería que el
diferente grado de lesiones gástricas causadas por el Helicobacter pylori entre
Nigeria y Sud África se debe en parte a diferentes expresiones de los factores
de patogenicidad de sus marcadores moleculares Cag A y Vac A. Esta observación
de tener infecciones por el Helicobacter pylori y poco cáncer gástrico con
grados diferentes de expresión de los factores patogenéti- cos Cag A y Vac A es
representativa del llamado “Enigma Africano” (Tabla 5).
Emergencia de
resistencia antibiótica del Helicobacter pylori
Otros puntos
importantes en la evaluación de los factores de riesgo para el carcinoma
gástrico en pacientes infectados por el Helicobacter pylori están basados en
fuentes ambientales de contaminación que facilitan la infección y el desarrollo
de resistencia antibiótica del Helicobacter. En una
colaboración entre las Universidades de Michigan en Ann Arbor, Cayetano Heredia
en Lima y la División de Salud Ambiental del MINSA en Lima, se estudió la
epidemiologia molecular del Helicobacter pylori con la hipótesis de que el agua
potable de Lima era una posible fuente de contaminación de la infección(21). Aunque no
se pudo cultivar la presencia del Helicobacter pylori en el agua potable, se
demostró la presencia qualitativa y quantitativa del ADN especifico del
Helicobacter pylori en el agua de la cocina de pacientes infectados con esta
bacteria. Además, se vio que la respuesta al tratamiento triple con
Amoxicilina, Claritromicina e Isomeprazol fue de solo 66% que estuvo muy debajo
de lo esperado en América
Latina(22). El seguimiento
de estos pacientes y el
tratamiento con terapia de segunda línea (tetraciclina, furazolidona,
subsalicilato de bismuto y pantoprazol) a aquellos que no respondieron al
tratamiento inicial, elevaron la respuesta al 85% al año del estudio.
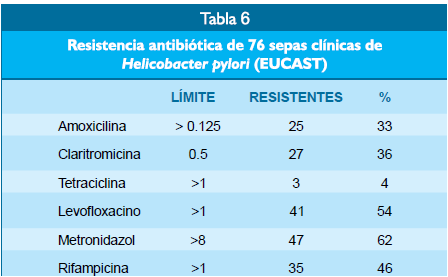
Se sospechó que la
baja respuesta al tratamiento fue debida a la presencia de resistencia antibiótica,
la que fue demostrada en la evaluación de 76 sepas del Helicobacter pylori de
pacientes del estudio(23). Usando el método europeo del EUCAST(24),
se demostró resistencia
antibiótica entre el 33% y el 62% de sepas a Amoxicilina,
Claritromicina, Levofloxacino y Mitronidazol, que son drogas de primera línea
para el tratamiento de infección por el Helicobacter pylori. Esta resistencia
antibiótica del Helicobacter pylori ha sido descrita en diferentes regiones del
mundo y como ejemplo, se cita la revisión de Vu Van Khien et al. en Vietnam
quien notó seis estudios incluyendo a 2,318 sepas del Helicobacter pylori,
demostrando resistencia antibiótica a Amoxicilina, Claritromi- cina,
Metronidazol y Levofloxacino en el 15%, 34%, 69% y 27% de sepas respectivamente(25)
(Tabla 6).
Conclusión
Los factores de
riesgo para el cáncer gástrico son múltiples. Incluyen al sexo masculino y edad
avanzada, ingesta alta de sal, alimentos conservados en sal, carnes y pescados
ahumados o secos, alimentos encurtidos, baja refrigeración, baja ingesta de
frutas y verduras con baja ingesta de vitaminas A y C; infección al
Helicobacter pylori, exposición a radiación, factores genéticos múltiples,
bajos niveles de actividad física, obesidad y pobreza o bajo nivel
socioeconómico.
Uno de los factores
de riesgo más importante es la pre- sencia de infección por el Helicobacter
pylori. Se le considera Carcinógeno tipo 1 debido a su efecto carcinogénico
directo en la mucosa gástrica con lesiones progresivas que constituyen la “Cascada
de Correa”. La
respuesta a la inflamación crónica y sostenida causada por el Helicobacter
produce lesiones que pueden evolucionar, a través de una serie de pasos
intermedios, de gastritis a cáncer. El daño de la infección en la mucosa gástrica
puede ser reversible con el tratamiento de la infección excepto cuando se llega
a la fase de metaplasia intestinal que con frecuencia representa el denominado
“punto de no retor- no”. El desarrollo de resistencia antibiótica del
Helicobacter pylori es preocupante ya que impide la recuperación de las
lesiones histológicas al tratamiento del Helicobacter pylori y facilita así el
desarrollo del cáncer gástrico.
Hacemos un llamado a
nuestras autoridades políticas y de salud pública para elaborar medidas de
prevención del carcinoma gástrico que lleve a disminuir los factores de riesgo
arriba mencionados, por lo menos en nuestra región andina donde las condiciones
de salubridad y el estado de pobreza de su población incrementan el riesgo de
desarrollar cáncer gástrico. Por otro lado, ya pasó el momento en el que
las sociedades científicas médicas y el Ministerio de Salud del Perú
desarrollen políticas de detección temprana de lesiones gástricas
pre-cancerosas para su monitoreo y seguimiento uniforme a través del país y así
llegar a la detección temprana del cáncer gástrico tal como se hace en el Japón
y en Corea del Sur. En estos países, personas mayores de 40 años son candidatos
para endoscopia del estómago, las que se repiten cada uno o dos años dependiendo
del tipo de lesión premaligna presente. Con este sistema de monitoreo
endoscópico se puede detectar carcinoma gástrico en estadios tempranos donde su
resección conlleva una curación de más del 80 - 90%. Este tipo de política
sanitaria debe ir mano a mano con programas de seguro de salud que cubrirían
los exámenes de detección con gastroscopias preventivas y diagnósticas. Solo
así podríamos mejorar el diagnóstico y el pronóstico de este terrible cáncer.
Referencias
bibliográficas
1. International
Agency for Research on Cancer; World Health Organization; GLOBOCAN 2020.
2. Salazar
MR, Regalado-Rafael R, Navarro JM, Montanez DM, Abugattas JE, Vidaurre T. El
Instituto Nacional de Enfermedades Neoplásicas en el control del cáncer en el
Perú. Rev Peru Med Exp Salud Pública. 2013;30(1):105-112.
3. Jaw-Town
Lin. Screening of Gastric Cancer: Who, When, and How. Clinical Gastroenterology
and Hepatology 2014;12:135- 138.
4. Crew KD,
Neugut AI. Epidemiology of gastric cancer. World J Gastroenterol
2006;12:354-362.
5. Fock KM,
Talley N, Moayyedi P, Hunt R, Azuma T, Sugano
K. et al.
Asia-Pacific consensus guidelines on gastric cancer prevention. J Gastroenterol
Hepatol 2008;23:351-365.
6. Perú:
Perfil Sociodemográfico 2017. Instituto Nacional de Estadística e Informática.
Censos Nacionales de Población y Vivienda 1993, 2007 y 2017. Capítulo 6:
Característica de los hogares; páginas 354-391.
7. de Vries AC, Haringsma J, Kuipers EJ. The detection, surveillance and treatment of premalignant gastric lesions related to Helicobacter pylori infection. Helicobacter
2007;12:1-15.
8. de Vries AC, van Grieken NC, Looman CW, Casparie MK, de Vries E, Meijer
GA, et al. Gastric
cancer risk in patients with premalignant gastric lesions: a nationwide cohort
study in the Netherlands. Gastroenterology 2008;134:945-952.
9. On On Chan
A, Wong B. Risk Factors for Gastric Cancer. UpToDate 2020. Literature review
current through: Dec 2020.
10. Piñeros M, Ramos W, Antoni S, Abriata G, Medina LE, Miranda JJ, et al. Cancer in
Peru 1. Cancer patterns, trends, and transitions in Peru: a regional
perspective. thelancet.com/ oncology 2017;18:e573-e586.
11. Torres J, Correa P, Ferreccio C, Hernandez-Suarez G, Herrero R,
Cavazza-Porro M, et al. Gastric cancer incidence and mortality is
associated with altitude in the mountainous regions of Pacific Latin America.
Cancer Causes Control. 2013;24(2):249-256.
12. Correa P,
Haenszel W, Cuello C, Tannenbaum S, Archer M. A model for gastric cancer
epidemiology. Lancet 1975;2:58-60.
13. Correa P,
Piazuelo MB. The gastric precancerous cascade. J Dig Dis. 2012;13(1):2-9.
14. Peek RM,
Crabtree JE. Helicobacter infection and gastric neoplasia. J Pathol 2006;208
(2):233-248.
15. Buti L,
Spooner E, Van der Veen AG, Rappuoli R, Covacci A, Ploeghet HL. Helicobacter
pylori cytotoxin-associated gene A (CagA) subverts the apoptosis-stimulating
protein of p53 (ASPP2) tumor suppressor pathway of the host. Proc Natl Acad Sci
U S A 2011;108:9238-9243.
16. Guo Y, Zhang Y, Gerhard M, Gao JJ, Mejias-Luque R, Zhang L, et al. Effect of
Helicobacter pylori on gastrointes- tinal microbiota: a population-based study
in Linqu, a high-risk area of gastric cancer. Gut 2019;0:1-10.
doi:10.1136/gutjnl- 2019-319696
17. Koulis A,
Buckle A, Boussioutas A. Premalignant lesions and gastric cancer: Current
understanding. World J Gastrointest Oncol 2019;11(9):665-678.
18. Huang KK,
Ramnarayanan K, Zhu F, Srivastava S, Xu C, Tan ALK, et al. Genomic and
Epigenomic Profiling of High- Risk Intestinal Metaplasia Reveals Molecular
Determinants of Progression to Gastric Cancer. Huang et al., Cancer Cell.
2018;33:137-150.
19. Song H,
Ekheden IG, Zheng Z, Ericsson J, Nyrén O, Ye W. Incidence of gastric cancer
among patients with gastric precancerous lesions: observational cohort study in
a low risk Western population. BMJ 2015;351:h3867 doi: 10.1136/bmj.h 3867.
20. Pilamides
P, Jolaiya T, Idowu A, Loell E, Onyekwere C, Ugiagbe R, et al. Helicobacter
pylori patient isolates from related to Helicobacter pylori pathogenicity
profile and associated gastric disease outcome. Scientific Reports; Nature
Research. 2020;10:11409. https://doi.org/10.1038/s41598-020-66128-0
21. Valdivieso,
M, Bussalleu, A, Sexton, R, Boehnke, K, Osorio, S, Novoa I, et al. Clinical,
Epidemiologic, and Genomic Studies (SWOG S1119) of Helicobacter Pylori in Lima,
Peru: Role of Contaminated Water. J. of Cancerol. 2016;2:52-63.
22. Greenberg
ER, Anderson GL, Morgan DR, Torres J, Chey WD, Bravo LE, et al. 14-day triple,
5-day concomitant and 10- day sequential therapies for Helicobacter pylori
infection in seven Latin American sites: a randomized trial. Published on line
by The Lancet on July 20, 2011. DOI: 10.1016/S0140-6736 (11) 60825-8.SWOG.
23. Boehnke K,
Valdivieso M, Bussalleu A, Sexton R, Thompson KC, Osorio S, et al. Antibiotic
resistance among Helicobacter pylori clinical isolates in Lima, Peru (SWOG
Clinical Trial 1119). Infection and Drug Resistance; 2017:10:85-90.
24. European
Committee on Antimicrobial Susceptibility Testing Breakpoint tables for
interpretation of MICs and zone diameters. Breakpoint tables for interpretation
of MICs and zone diameters. Version 5.0 [Internet]. Proteus. 2015. Available
from: http://www.eucast.org
25. Khien VV,
Thang DM, Hai TM, Duat NQ, Khanh PH, Ha DT, et al. Management of
Antibiotic-Resistant Helicobacter pylori Infection: Perspectives from Vietnam.
Gut and Liver. 2019;1(5);483-497.
1Director de
Educación, Peruvian American Medical Society (PAMS), Profesor Adjunto,
Departamento de Medicina Interna, ALCANCE
GLOBAL, Universidad
de Michigan, Ann Arbor, Michigan. ORCID ID: 0000-0002-3292-1475.
Contribución de
autoría: Manuel Valdivieso Rodríguez ha sido el autor de esta publicación,
contribuyendo a su concepción, organización de la presentación científica,
búsqueda electrónica, revisión inicial, redacción, revisión y aprobación final.
Conflicto de interés:
El autor no tiene conflicto de interés con la publicación de este trabajo.
Financiamiento:
Autofinanciado.
Citar como:
Valdivieso Rodríguez M. Carcinoma Gástrico: Factores de riesgo. Rol de
Helicobacter Pylori. Diagnóstico(Lima). 2021;60(2):79-85.
DOI:
10.33734/diagnostico.v60i2.284
Correspondencia:
Manuel Valdivieso Rodríguez. Correo electrónico: m.valdivieso.md@outlook.com
![]()
![]()
![]() Antecedentes
Antecedentes![]()
![]() El carcinoma del
estómago es uno de los más frecuen- tes, ocupando el quinto lugar en
frecuencia, y el número cuatro en mortalidad global en el año 2020. Esto
representa 1'089,103 de diagnósticos nuevos y 768,793 de muertes al año. Es más
común en el Asia Oriental, particularmente en China, Japón, Corea del Sur;
Europa del Este, Centroamérica y Sudamérica. Áreas de baja incidencia incluyen
a Australia, Nueva Zelanda, América del Norte, Europa Occidental, Asia -sub
Central y la mayor parte del África.
El carcinoma del
estómago es uno de los más frecuen- tes, ocupando el quinto lugar en
frecuencia, y el número cuatro en mortalidad global en el año 2020. Esto
representa 1'089,103 de diagnósticos nuevos y 768,793 de muertes al año. Es más
común en el Asia Oriental, particularmente en China, Japón, Corea del Sur;
Europa del Este, Centroamérica y Sudamérica. Áreas de baja incidencia incluyen
a Australia, Nueva Zelanda, América del Norte, Europa Occidental, Asia -sub
Central y la mayor parte del África.![]()
![]()
![]()
![]() 2. De acuerdo a
Globocan en el año 2020, el cáncer gástrico fue tercero en frecuencia detrás
solamente a cánceres de próstata y mama; mientras que fue el primero en
mortalidad seguido de cánceres del pulmón, próstata y colorectal(1). La
mortalidad por el cáncer de estómago en nuestro medio y en muchos países de
Centroamérica y América del Sur se debe a lo avanzado de este cáncer cuando se
le diagnostica. Se estima que hasta el 75% de pacientes con cáncer,
incluyendo los del estómago, se presentan al Instituto Nacional de Enfermedades
Neoplásicas e Lima en estado avanzado(2).
2. De acuerdo a
Globocan en el año 2020, el cáncer gástrico fue tercero en frecuencia detrás
solamente a cánceres de próstata y mama; mientras que fue el primero en
mortalidad seguido de cánceres del pulmón, próstata y colorectal(1). La
mortalidad por el cáncer de estómago en nuestro medio y en muchos países de
Centroamérica y América del Sur se debe a lo avanzado de este cáncer cuando se
le diagnostica. Se estima que hasta el 75% de pacientes con cáncer,
incluyendo los del estómago, se presentan al Instituto Nacional de Enfermedades
Neoplásicas e Lima en estado avanzado(2).![]()
![]()
![]() Los factores de
riesgo para el cáncer gástrico son últiples (Tabla 3). Incluyen al sexo
masculino, edad avanza- a, ingesta alta de sal, alimentos conservados en sal,
carnes y escados ahumados o secos, alimentos encurtidos, baja efrigeración,
baja ingesta de frutas y verduras con baja ingesta e vitaminas A y C; infección
debida al Helicobacter pylori y al virus Epstein Barr, exposición a radiación,
factores genéticos múltiples, bajos niveles de actividad física, obesidad y
nivel socioeconómico bajo(3-5).
Los factores de
riesgo para el cáncer gástrico son últiples (Tabla 3). Incluyen al sexo
masculino, edad avanza- a, ingesta alta de sal, alimentos conservados en sal,
carnes y escados ahumados o secos, alimentos encurtidos, baja efrigeración,
baja ingesta de frutas y verduras con baja ingesta e vitaminas A y C; infección
debida al Helicobacter pylori y al virus Epstein Barr, exposición a radiación,
factores genéticos múltiples, bajos niveles de actividad física, obesidad y
nivel socioeconómico bajo(3-5).