Simposio sobre
Abdomen Agudo - Segunda Parte
Actualización en
Pancreatitis Aguda
Fernando
Revoredo-Rego 1,
José de Vinatea-de Cárdenas 1,2
DOI: https://doi.org/10.33734/diagnostico.v60i1.273
Definición
La pancreatitis es un
proceso inflamatorio agudo del páncreas con compromiso variable de otros
tejidos regionales u órganos y sistemas remotos(1). Se caracteriza por la
activación celular intra acinar de las enzimas digestivas y la subsecuente
liberación de citoquinas proinflamatorias(2).
Diagnóstico
Para
el diagnóstico se requiere al menos dos de las siguientes características(3):
1. Dolor
abdominal congruente con pancreatitis aguda (dolor epigástrico de inicio agudo,
persistente, severo que a menudo se irradia a la espalda).
2. Actividad
de lipasa sérica (o amilasa sérica) al menos 3 veces por arriba del límite
superior de lo normal.
3. Hallazgos
radiológicos característicos de pancreatitis aguda en tomografía contrastada,
Resonancia Magnética nuclear o ultrasonografía.
Los niveles de
amilasa empiezan a elevarse tan pronto se establece la pancreatitis, llegando a
su pico máximo a las 48 horas y después de un período de 5 a 7 días tienden a
normalizarse. Los niveles de lipasa también alcanzan su pico máximo a las 48
horas, sin embargo, tiende a normalizarse después de 8 a 14 días(4).
Existen otras causas
de elevación de la amilasa y de la lipasa que se deben tener en cuenta dentro
del diagnóstico diferencial: pseudoquiste pancreático, pancreatitis crónica,
carcinoma pancreático, enfermedades del tracto biliar (colecistitis,
colangitis, coledocolitiasis), obstrucción intestinal, isquemia o perforación
intestinal, apendicitis aguda, embarazo ectópico, insuficiencia renal,
peritonitis, parotiditis, macroamilasemia, neoplasias quísticas del ovario, carcinoma pulmonar, cetoacidosis
diabética, traumatismo encéfalo craneano con sangrado, aneurisma roto de aorta
abdominal, infección por VIH, rechazo de injerto de trasplante de
páncreas(5,6).
Existen dos isoformas
de amilasa en el ser humano, la pancreática (amilasa-p) y la salival
(amilasas). La amilasap se sintetiza en las células acinares pancreáticas y se
secreta al intestino a través del sistema ductal pancreático. La amilasas se
sintetiza en las glándulas salivales. También se han encontrado amilasas en los
ovarios, trompas de Falopio, músculo estriado, pulmones, tejido adiposo,
calostro, lágrimas y leche(7).
Se han estudiado
otros biomarcadores como potenciales predictores tempranos de la severidad de
la pancreatitis aguda. La proteína C reactiva (PCR) se incrementa durante la
inflamación y después del daño tisular. Se ha propuesto que un punto de corte
de 140 mg/L puede diferenciar una pancreatitis edematosa de una necrotizante.
Un incremento de los valores de esta proteína se usa para determinar que
pacientes requieren un control tomográfico(7).
La procalcitonina se
eleva en pacientes con sepsis. Un valor de procalcitonina de 3.8 ng/ml o más
después de 96 horas del establecimiento de la pancreatitis, indica la presencia
de necrosis con una sensibilidad y especificidad de 93% y 79% respectivamente.
La procalcitonina es el estudio de laboratorio con mayor sensibilidad para
detectar necrosis pancreática infectada(7).
En la gran mayoría de
pacientes con pancreatitis aguda, no se requiere tomografía para el
diagnóstico. La extensión de la necrosis se detecta mejor con la tomografía
contrastada después de las 72 horas. La tomografía temprana debe realizarse
cuando haya dudas en el diagnóstico, especialmente para descartar peritonitis
secundaria a perforación o isquemia mesentérica(7).
La tomografía es el
estudio de elección para el diagnóstico, estadiaje de la severidad y detección
de las complicaciones de la pancreatitis aguda. La resonancia magnética es
usada en los pacientes con alergia al contraste iodado, pacientes con
insuficiencia renal, en pacientes jóvenes y en gestantes para minimizar la
exposición a la radiación(7).
Etiología(6)
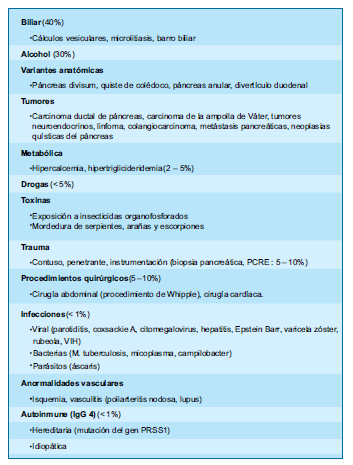


 Basándose
en la frecuencia, se recomienda que todo paciente con diagnóstico de
pancreatitis aguda debe tener una ecografía abdominal para el estudio de los
cálculos de la vesícula biliar. En la ausencia de éstos, se debe investigar el
consumo de alcohol. Si no hay historia de consumo de alcohol se debe dosar
triglicéridos séricos (un resultado es > 1 000mg/dL confirmaría la
etiología). En pacientes mayores de 40 años se debe considerar la posibilidad
de neoplasias(8).
Basándose
en la frecuencia, se recomienda que todo paciente con diagnóstico de
pancreatitis aguda debe tener una ecografía abdominal para el estudio de los
cálculos de la vesícula biliar. En la ausencia de éstos, se debe investigar el
consumo de alcohol. Si no hay historia de consumo de alcohol se debe dosar
triglicéridos séricos (un resultado es > 1 000mg/dL confirmaría la
etiología). En pacientes mayores de 40 años se debe considerar la posibilidad
de neoplasias(8).
Tipos de Pancreatitis
La
pancreatitis aguda se puede subdividir en dos tipos(3):
Pancreatitis aguda
edematosa intersticial: la gran mayoría de pacientes tiene este tipo de
pancreatitis. Se caracteriza por un crecimiento difuso (u ocasionalmente
localizado) del páncreas debido a edema inflamatorio. En la tomografía se puede
observar un parénquima homogéneo y la grasa peripancreática muestra cambios
inflamatorios. Podría haber colección líquida peripancreática. Los síntomas se
resuelven dentro de la primera semana(3).
Pancreatitis aguda
necrotizante: 5 - 10% de pacientes desarrollan necrosis del parénquima
pancreático, el tejido peri pancreático o ambos. Es más común la necrosis que involucre el páncreas y el tejido peri pancreático y
menos común es la necrosis del tejido peri pancreático solo. Se considera que
la necrosis está infectada cuando hay gas en el tejido pancreático o
peripancreático en la tomografía o cuando la aspiración con aguja fina es
positiva para bacterias y/o hongos en el gram o cultivo(3).
Complicaciones
Locales
Se sospechan cuando
hay persistencia o recurrencia de dolor abdominal, incremento de la
actividad sérica de las enzimas pancreáticas, incremento en la
disfunción orgánica y/o desarrollo
de los signos
clínicos de sepsis
como fiebre y leucocitosis(3).
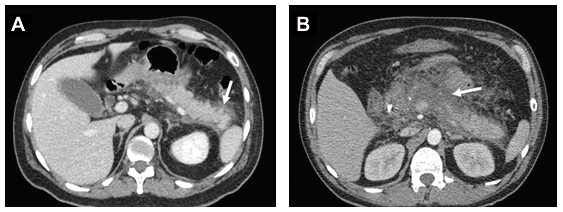
Figura
1.
A:
Pancreatitis aguda edematosa intersticial. La flecha indica cambios inflamatorios
de la grasa peri pancreática.
B:
Pancreatitis aguda necrotizante. La flecha indica necrosis de la glándula y de
la grasa peri pancreática.
Complicaciones
de la Pancreatitis Aguda
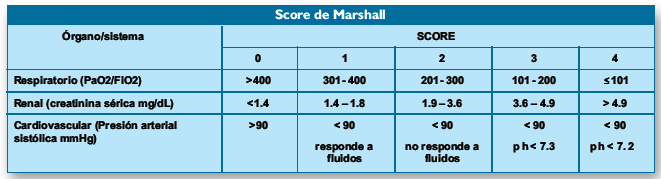
Falla
Orgánica
Se deben evaluar 3 sistemas
para definir falla orgánica: respiratorio, cardiovascular y renal. La falla
orgánica se define como un score de Marshall de 2 o más(3).
Si los pacientes no
están en ventilación mecánica, el FiO2 puede calcularse de la siguiente manera:
Colección peri
pancreática aguda: asociada a pancreatitis aguda edematosa intersticial, sin
necrosis peri pancreática. Se presenta dentro de las primeras 4 semanas. En la
tomografía se observa una densidad líquida homogénea y no hay una pared que la
encapsule.
Pseudoquiste
pancreático: colección líquida encapsulada, con una pared inflamatoria bien
definida con mínima o sin necrosis. En tomografía se observa una densidad
líquida homogénea, con una pared bien definida. Ocurre después de 4 semanas del
inicio de una pancreatitis aguda edematosa intersticial.

Colección necrótica
aguda: colección de cantidades variables de líquido y necrosis asociada a una
pancreatitis aguda necrotizante. Se presenta en las primeras 4 semanas. En la
tomografía se observa densidad heterogénea de los tejidos pancreáticos o peri
pancreáticos y no hay una pared definida.
Necrosis encapsulada:
colección encapsulada de tejido pancreático y/o peri pancreático necrótico que
ha desarrollado una pared de tejido inflamatorio bien definida. Ocurre después
de 4 semanas del inicio de una pancreatitis aguda neocrotizante.
Otras:
disfunción del vaciamiento gástrico, trombosis venosa portal y esplénica y
necrosis colónica.
Algunas
ventajas de la resonancia magnética son: no requiriere radiación ionizante,
permite una mejor evaluación del componente sólido (detritus) al interior de
las colecciones, permite hacer una evaluación de la continuidad del conducto
pancreático y también permite hacer un estudio de la vía biliar
(coledocolitiasis)(9).
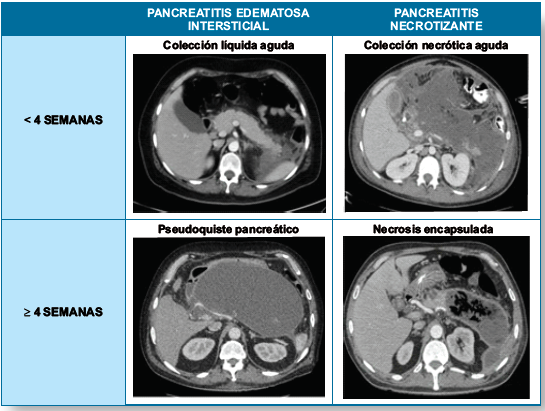
Figura
2 Complicaciones locales de la pancreatitis aguda.
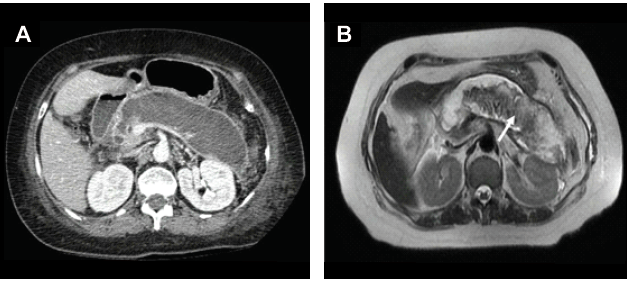
Figura
3.
A:
Tomografía que muestra una colección líquida en la celda pancreática compatible
con pseudoquiste. B: Resonancia Magnética muestra la presencia de detritus
dentro de la colección (flecha) compatible con necrosis encapsulada. Ambos
estudios son del mismo paciente.
Complicaciones
Sistémicas
Exacerbación de las
comorbilidades preexistentes como enfermedad coronaria o enfermedad pulmonar
crónica.
Grados de Severidad
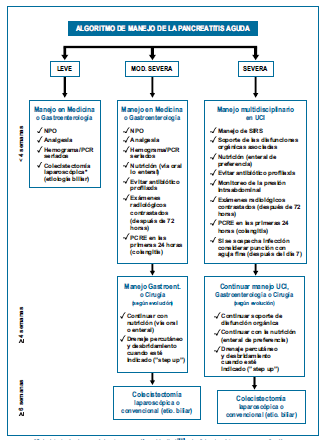
de la Pancreatitis Aguda Pancreatitis Aguda Leve(3)
No hay falla orgánica
y no hay complicaciones locales o sistémicas.
Pancreatitis Aguda
Moderadamente Severa(3)
Hay falla orgánica
que se resuelve dentro de las primeras 48 horas (falla orgánica transitoria)
y/o complicaciones locales o sistémicas sin falla orgánica persistente.
Pancreatitis Aguda
Severa(3)
Hay falla orgánica
persistente (más de 48 horas). La falla puede ser de un órgano o multiorgánica.
Curso de la
Pancreatitis Aguda(10)
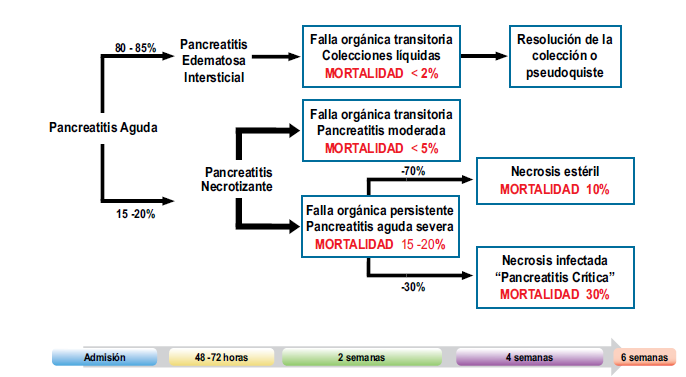
Existen dos fases que
se superponen en este proceso dinámico de la enfermedad, con dos picos de
mortalidad: la fase temprana y la fase tardía. La fase temprana, la cual dura
generalmente las dos primeras semanas y en la que la falla orgánica se debe a
la respuesta inflamatoria sistémica (SIRS) y está mediada por una respuesta
proinflamatoria (TNF, IL1, IL2, Il6). La fase tardía (después de las dos
primeras semanas) está caracterizada por una respuesta antiinflamatoria (CARS)
que aumenta el riesgo de infección, causante de la falla orgánica y
mortalidad(3,11).
Intervencion en la
Fase Incial de la Pancreatitis Aguda Severa (1 - 2 Semanas)
El manejo de los
pacientes con pancreatitis aguda severa debe hacerse en centros de referencia
especializados y con un abordaje multidisciplinario que incluya intensivistas,
nutricionistas, radiólogos intervencionistas, gastroenterólogos endoscopistas
con experiencia y cirujanos de páncreas(12).
Resucitacion
con Fluidos
La resucitación puede
hacerse con lactato Ringer o suero salino. El lactato Ringer tiene efectos
antiinflamatorios y está asociado con
una disminución de la respuesta inflamatoria sistémica(13).
La resucitación
inicial con fluidos debe hacerse a razón de 5-10ml/kg/h, hasta que se alcancen
las “metas de la resucitación”, las cuales se pueden dividir en(14,15):
Metas
no invasivas:
·
Frecuencia cardíaca < 120 latidos/min.
·
Presión arterial media de 65 - 85mmHg.
·
Flujo urinario > 0.5 - 1ml/kg/h.
-Metas
bioquímicas:
·
Hematocrito de 35 - 44%
Rol
de los Antibioticos
No se recomienda el
uso de antibióticoprofilaxis para prevenir las complicaciones infecciosas en
pancreatitis aguda. Los antibióticos están indicados solamente cuando la infección
de la necrosis está probada o cuando se sospecha clínicamente (16-18).
Nutrición
La nutrición enteral
es la de primera elección. La nutrición a través de sondas se debe reservar a
los pacientes con ingesta calórica insuficiente después de 3 - 5 días. La
nutrición enteral por sonda nasogástrica o nasoyeyunal son factibles y
seguras(19,29,21).
La nutrición
parenteral se debe administrar en los pacientes que no toleran la nutrición
enteral o en los que haya contraindicación de nutrición enteral como
obstrucción intestinal, síndrome compartimental abdominal, íleo paralítico
prolongado e isquemia mesentérica(22).
Procedimientos
Invasivos
No existe un rol para
la intervención invasiva en las primeras dos semanas. Por lo tanto, se debe
evitar la pancreatocolangiografía retrógrada endoscópica, el drenaje
percutáneo, los procedimientos trans gástrico y sobre todo la cirugía, ya que
ésta induce un estrés adicional a un paciente críticamente enfermo. Las
excepciones son el síndrome compartimental abdominal, el sangrado y la isquemia
o perforación intestinal(23,24).
El síndrome
compartimental abdominal se define como la elevación sostenida de la presión
intraabdominal >20mmHg, asociada con la aparición de una nueva falla
orgánica o el empeoramiento agudo de una falla orgánica existente. Los síntomas
incluyen abdomen distendido, oliguria y aumento de la presión pico de la
ventilación mecánica(24). El método que se recomienda para medir la presión
intraabdominal es transvesical y se debe medir al final de la espiración y en
posición supina(25). El manejo del síndrome compartimental en pancreatitis
aguda es escalonado, esto incluye un manejo no invasivo inicial: alivio del
dolor y la ansiedad, bloqueo neuromuscular, descompresión enteral (sonda
nasogástrica a gravedad, sonda rectal y suspender la nutrición enteral), evitar
balance hídrico positivo. Si no se controla el síndrome compartimental
abdominal, el siguiente paso es un manejo mínimamente invasivo (drenaje
percutáneo de las colecciones intraabdominales). Si no hay mejoría, el último
paso es la laparotomía descompresiva(25).
La laparotomía descompresiva tiene una mortalidad de 80 a
100%(23).
Intervencion
en la Fase Tardía de la Pancreatitis Aguda Severa (3 - 4 semanas)
Se
debe posponer la intervención 3 - 4 semanas ya que esto permite la
encapsulación de las colecciones y reduce las complicaciones(26,27).
Las
indicaciones de intervención en la fase tardía son (28,29):
1. Necrosis
infectada (gas en la tomografía o cultivo positivo obtenido por aspiración con
aguja fina) en un paciente que no evoluciona bien clínicamente.
2. Sepsis
persistente.
Paciente
que, a pesar de no tener evidencia de necrosis infectada, no tiene una buena
evolución clínica (intolerancia oral, dolor abdominal, hiperamilasemia,
náuseas, vómitos, febrícula).
La intervención en la
pancreatitis aguda severa es escalonada (step up approach). Se debe retardar el
mayor tiempo posible, utilizando el soporte y antibioticoterapia dirigida. Si
el paciente no evoluciona favorablemente, el siguiente paso es el drenaje
percutáneo o el drenaje endoscópico. Si a pesar de esto el paciente no mejora,
el siguiente paso es el desbridamiento de la necrosis (necrosecto mía)(28,30).
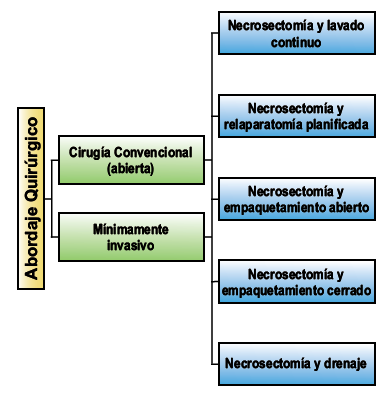
Las opciones para realizar la necrosectomía son las siguientes:
Cuando se compararon
estos abordajes quirúrgicos, ninguno demostró ser mejor que otro en cuanto a
mortalidad. La necrosectomía y relaparotomía planificada tuvo mayor incidencia
de fístula intestinal, la necrosectomía y empaqueta- miento abierto tuvo mayor
incidencia de sangrado y fístula pancreática. La necrosectomía con lavado
continuo tuvo menor incidencia hemorragia, fístula intestinal y fístula
pancreática (31).
ABORDAJES
QUIRÚRGICOS
Las metas de la
necrosectomía son: el control de la infección, la máxima evacuación del tejido
desvitalizado y la preservación del tejido vital(32).
El tiempo para la
necrosectomía ha ido cambiando con el tiempo. En los años 60 hasta los 90, la
necrosectomía se hacía tempranamente, a mediados de los 90 se empezó a retrasar
la cirugía para la necrosis infectada de 2 a 3 semanas y actualmente se retrasa
la cirugía idealmente más de 4 semanas (32). Esto basado en estudios en los que
se ha demostrado que la mortalidad es de 75% cuando se hace la necrosectomía en
las primeras 2 semanas. Si la necrosectomía se realiza entre los 15 a 29 días,
la mortalidad es de 45% y si la necrosectomía se realiza después del día 30, la
mortalidad es de 8%. El retrasar la cirugía permite que la respuesta
inflamatoria sistémica y la inflamación disminuyan, hay menos sangrado, se
demarca mejor el tejido necrótico y se forma una pared que encapsula la
necrosis(33).
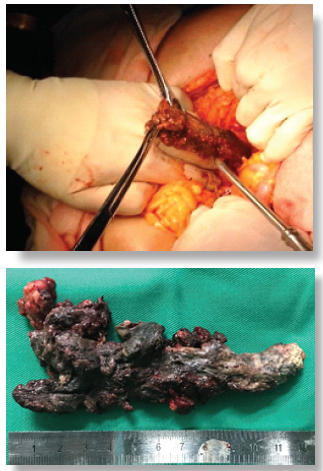
Figura
4.
A:
Tomografía que muestra una colección líquida en la celda pancreática compatible
con pseudoquiste. B: Resonancia Magnética muestra la
ABORDAJES
MÍNIMAMENTE INVASIVOS
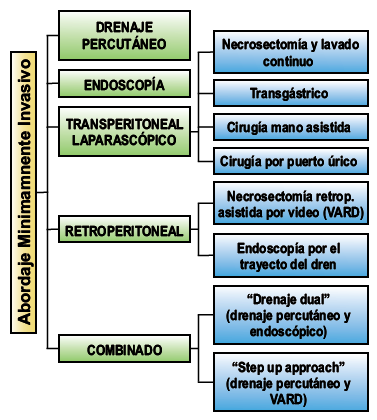
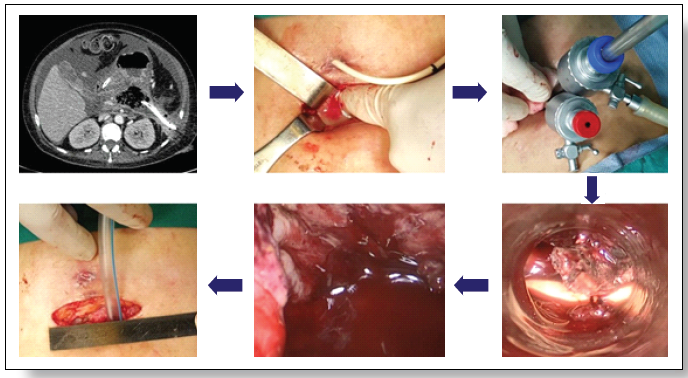
Figura 5.
Necrosectomía retroperitoneal asistida por video (Video Assisted
Retroperitoneal Debridement VARD). Se realiza una incisión lumbar de 5cm y
siguiendo el trayecto de un dren percutáneo previamente colocado, se aborda la
celda pancreática, realizándose una necrosectomía bajo visión directa.
Finalmente se coloca un drenaje tubular.
Curso
de la Pancreatitis Necrotizante
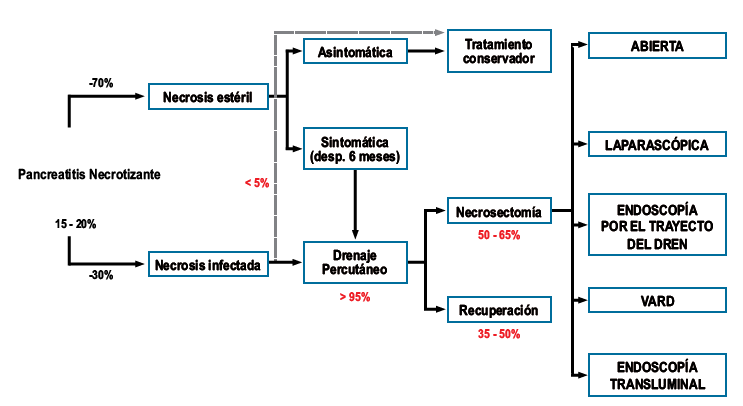
Solo el 15 - 20% de
las pancreatitis son necrotizantes, de éstas el 70% aproximadamente son
necrosis estériles queson asintomáticas y tienen una buena evolución clínica
con manejo.
conservador(10,28). Cuando
la necrosis estéril
se vuelve sintomática (fiebre,
dolor abdominal, náuseas, vómitos), se trata como una necrosis infectada. Solo
el 15 - 20% de las necrosis pancreáticas se infectan, y es aquí donde se hace
el manejo escalonado (step up). Inicialmente se maneja con antibióticos de
amplio espectro; un 5% aproximadamente de necrosis infectadas evolucionan
favorablemente solamente con antibioticoterapia. Si no hay mejoría clínica, el
siguiente paso es el drenaje percutáneo; entre 35 - 50% de los pacientes con
necrosis infectada evolucionan favorablemente con el drenaje y ya no requieren
otra intervención. Cuando el manejo con antibióticos y drenaje percutáneo
fracasa, es cuando se realiza la necrosectomía en cualquiera de sus formas(28).
Cuando
realizar la Colecistecomía en un paciente con Pancreatitis Aguda
La colecistectomía en
el contexto de una pancreatitis aguda leve se debe realizar en la misma
hospitalización, cuando los síntomas hayan remitido y cuando la amilasa/lipasa
y PCR se hayan normalizado(34,35). La
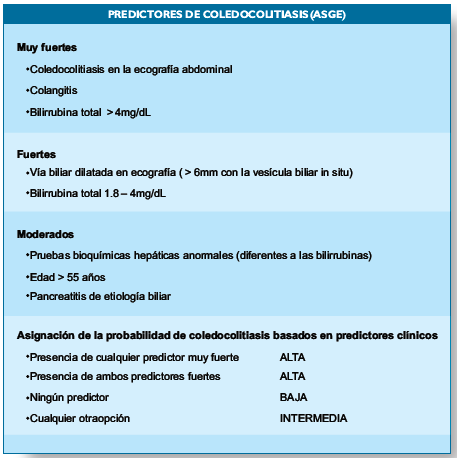
colangioresonancia o la pancreatocolangiografía retrógrada
endoscópica (PCRE) se realizará previa a la cirugía, según la estratificación
de los predictores de coledocolitiasis(36).
A los pacientes con
probabilidad baja se les realizará solamente una colecistectomía laparoscópica.
Los pacientes con probabilidad intermedia, dependiendo de los costos y la
experiencia local, tienen dos opciones; la primera es programarlos para una
colecistectomía laparoscópica y durante la cirugía realizar una colangiografía
intraoperatoria o una ecografía laparoscópica intraoperatoria. La segunda
opción es realizar una colangioresoancia o eco-endoscopía preoperato- ria. Los
pacientes con probabilidad alta deben realizarse una PCRE antes de la
cirugía(36).
En los pacientes con
pancreatitis biliar necrotizante, la colecistectomía debe diferirse hasta que
la inflamación disminuya y las colecciones líquidas se resuelvan o se
estabilicen para prevenir la infección de estas. Esto sucede aproximadamente 6
semanas después del inicio de la pancreatitis(8,18). Se
puede realizar una
colecistectomía en el contexto de una necrosectomía, en
pacientes seleccionados y cuando sea técnicamente factible(37).
Referencias
bibliográficas
1. Bradley III EL. A
clinically based classification system for acute
pancreatitis. Sumary of the International
Symposium on Acute Pancreatitis,
Atlanta Ga, september 11 trough 13,
1992. Arch Surg. 1993;128:586-590.
2. Connor S, Alexakis N, Raraty MG, et al. Early and late complications
after pancreatic necrosectomy. Surgery. 2005;137:499-505.
3. Banks P, Bollen TL, Dervenis
C, et al. Classification of acute pancreatitis - 2012 revision
of the Atlanta classification and definitions
by international consensus. GUT, 2013;62:102-111.
4. Jasdanwala S, Babyatsky M. A critical
evaluation of serum
lipase and amylase as diagnostic test for acute pancreatitis. Integr
Mol Med. 2015;
2(3):189-195.
5. Hameed AM, Lam VW. Pleass
HC. Significant elevations of serum liase not
caused by pancreatitis: s systematic review. HPB. 2015;17(2):99-112.
6. Forsmark CE, Baillie J. AGA
Institute technical review on acute pancreatitis. Gastroenterology. 2007;132(5):2022-2044.
7. Leppäniemi A, Toloe M, Tarasconi A, et al. 2019 WSES guidelines for the management of severe acute
pancreatitis. World J Emerg Sug. 2019;13:14- 27.
8. Tenner S, Baillie J, SeWitt J, et al. American College of Gastroenterology guideline:
management of acute pancreatitis. Am J Gastroenterol. 2013; 108(9):1400-1415.
9. Dhaka N, Samanta J, Kochhar
S, et al. Pancreatic fluid collections: What is the ideal imaging
technique? World J Gastroenterol. 2015;21(48):13403- 13410.
10.
Forsmark CE, Vege SS, Wilcox
CE. Acute pancreatitis. N Engl J Med. 2016;375:1972-1981.
11.
Zerem E. Treatment of severe acute pancreatitis and its complications. World J Gastroenterol. 2014;20(38):13879-13892.
12.
Baron TH, DiMaio CJ, Wang AY, et al. American Gastroenterological Association Clinical
Practice Update: management of pancreatic necrosis. Gastroenterology. 2020;158(1):67-75.
13.
Iqbal U, Anwar H, Scribani M. Ringer´s lactate
versus normal saline in acute pancreatitis. A systematic review
and meta analysis. J Dig Dis. 2018; 19(6):335-341.
14.
Mao
EQ, Tang YQ, Fei J, et al. Fluid
therapy for severe acute pancreatitis in acute response
stage. Chin Med J 2009;122:169-173.
15.
Mao EQ, Fei J, Peng YB, et al. Rapid hemodilution is associated with increased
Sepsis and mortality among patients with severe acute pancreatitis. Chin Med J 2010;123:1639-1644.
16.
Villatoro
E, Mulla M, Larvin M. Antibiotic therapy for
prophylaxis against infection of pancreatic necrosis
in acute pancreatitis. In. Larvin M, ed. Cochrane Database
Syst Rev 2010.
17.
Lim
CL, Lee W, Liew YX, et al. Role
of antibiotic prophylaxis in necrotizing
pancreatitis: a meta-analysis. J
Gastrointest Surg 2015;19:480-491.
18.
Working
Group IAP/APA acute pancreatitis guidelines. IAP/APA evidence-based guidelines for the
management of acute pancreatitis. Pancreatology. 2013;13:e1-15.
19.
Al-Omran
M, Albalawi ZH, Tashkandi MF, et al.
Enteral versus parenteral nutrition for acute pancreatitis. Cochrane Database Syst Rev 2010.
20. Bakker OJ, van Brunschot S, van Santvoort HC, et al. Early versus on-demand nasoenteric tube feeding
in acute pancreatitis. N Engl J Med 2014; 371:1983-1893.
21.
Stimac D, Poropat G, Hauser G, et al. Early nasojejunal tube feeding versus
nil-by-mouth in acute pancreatitis: a randomized clinical trial. Pancreatology. 2016;16:523-528.
22.
Arvanitakis M Ockenga J, Bezmarevic M, et al. ESPEN guideline on clinical nutrition in acute and chronic
pancreatitis. Clin Nutr. 2020;s0261- 5614(20)30009.
23.
De
Waele JJ, Hoste E, Blot SI, et al. Intra
abdominal hypertension in patients with
severe acute pancreatitis. Crit Care. 2005;9(4):R452-R457.
24.
Van Brunschot S,
Schut AJ, Bouwense SA, et al. Abdominal
compartment síndrome in acute pancreatitis. A systematic
review. Pancreas. 2014:43;665 - 674.
25.
Kirkpatrick
AW, Roberts DJ, De Waele J, et al. Intra
abdominal hypertension and the abdominal compartment syndrome: updated
consensus definitions and clinical practice guidelines from the World Society of the Abdominal Compartment Syndrome. Intensive Care Med. 2013;39:1190 - 1206.
26.
Besselink
MG, Verwer TJ, Schoenmaeckers EJ, et
al. Timing of surgical intervention in
necrotizing pancreatitis. Arch Surg. 2007; 142(12):1194- 1201.
27.
Van Santvoort
HC, et al. A conservative and minimally invasive approach to
necrotizing pancreatitis improves
outcomes. Gastroenterology. 2011; 141(4):1254-1263.
28.
Hollemans
RA, van Brunschot S, Bakker OJ, et al. Minimally
invasive intervention for infected necrosis in acute pancreatitis. Expert Rev. Med. Devices. 2014;11(6):637-648.
29.
Rodríguez
JR, et al. Debridement and closed packing for
sterile or infected necrotizing pancreatitis. Insigths into indications and outcomes in 167 patients. Ann Surg. 2008;247.
30.
Van Santvoort
HC, Besselink MG, Bakker OJ, et al. A
step up approach or open necrosectomy for necrotizing pancreatitis. N Engl J
Med. 2010;362 (16):1491-1502.
31.
Werner
J, Feuerbach S, Uhl W, Buchler M. Management
of acute pancreatitis: from surgery
to interventional intensive care. GUT. 2005;54: 426-436.
32.
Warshaw AL. Improving the treatment of necrotizing pancreatitis a step up.
N Engl J Med. 2010; 362 (16):1535-1537.
33.
Besselink
MG, Verwer TJ, Schoenmaeckers EJ, et
al. Timing of surgical
intervention in necrotizing
pancreatitis. Arch Surg. 2007;142(12):1194-1201.
34.
daCosta DW, Bouwense
S, Schepers N, et al. Same-admission versus
Interval cholecystectomy for mild gallstone pancreatitis (PONCHO): a multicentre
randomised controlled trial. The Lancet. 2015; 386:1261- 1268.
35.
Yang FJ, LuHM,
Guo Q, et al. Timing of laparoscopic cholecystectomy after mild biliary pancreatitis: a systematic review
and meta-analysis. J Laparoendosc Adv Surg Tech. 2018; 28(4):379-388.
36.
ASGE standards of practice commitee. Maple JT, Ben-Menachem T, Anderson
MA, et al. The role of endoscopy in the evaluation of suspected choledocholitiasis. Gastrointest Endosc.
2010;71(1):1 - 9.
37.
Fong ZV, Peev M, Warshaw
AL, et al. Single stage cholecystectomy at the time of pancreatic necrosectomy is
safe and prevents future biliary complications: a 20-year single institutional
experience with 217 consecutive patients. J Gastrointest Surg. 2015;19(1):32-38.
______________________________________________________________________________
1Cirujano General
Hospital Nacional Guillermo
Almenara Irigoyen. 2Profesor Principal de Cirugía Universidad Nacional Mayor de San
Marcos.
______________________________________________________________________________
Contribución de autoría: Fernando RevoredoRego ha
participado en la concepción del artículo, la redacción del manuscrito, la
revisión crítica del manuscrito y aprobación de su versión final. José de
Vinateade Cárdenas ha participado en la concepción del artículo, la redacción
del manuscrito, la revisión crítica del manuscrito y aprobación de su versión
final.
Conflicto de interés: Los autores no tienen conflictos de
interés con la publicación de este trabajo. Financiamiento: Autofinanciado.
Citar como: Revoredo-Rego, F. y col. Actualización en
Pancreatitis Aguda. Diagnóstico(Lima). 2021;60(1):12-22. DOI:
10.33734/diagnostico.v60i1.273
Correspondencia: José de Vinatea-de Cárdenas. Correo
electrónico: josedevinatea@gmail.com
![]()
![]()
![]() Basándose
en la frecuencia, se recomienda que todo paciente con diagnóstico de
pancreatitis aguda debe tener una ecografía abdominal para el estudio de los
cálculos de la vesícula biliar. En la ausencia de éstos, se debe investigar el
consumo de alcohol. Si no hay historia de consumo de alcohol se debe dosar
triglicéridos séricos (un resultado es > 1 000mg/dL confirmaría la
etiología). En pacientes mayores de 40 años se debe considerar la posibilidad
de neoplasias(8).
Basándose
en la frecuencia, se recomienda que todo paciente con diagnóstico de
pancreatitis aguda debe tener una ecografía abdominal para el estudio de los
cálculos de la vesícula biliar. En la ausencia de éstos, se debe investigar el
consumo de alcohol. Si no hay historia de consumo de alcohol se debe dosar
triglicéridos séricos (un resultado es > 1 000mg/dL confirmaría la
etiología). En pacientes mayores de 40 años se debe considerar la posibilidad
de neoplasias(8).